题目内容
【题目】某工业粗盐水中含有Ca2+、NH4+等杂质,可用下列方法去除(部分产物、步骤略去):

请回答下列问题:
(1)过程I中,除去粗盐水中Ca2+需加入的试剂a是______。
(2)盐泥的成分是_______。
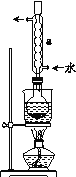
(3)实验室由MnO2与浓盐酸混合加热制取Cl2的化学方程式是_______。
(4)若1 mol MnO2完全反应,在标准状况下生成Cl2的体积是_______L。
(5)过程II中,在碱性条件下Cl2将NH4+氧化为N2而除去,其离子方程式是_______。
【答案】Na2CO3 CaCO3 MnO2 + 4HCl(浓)![]() MnCl2 + 2H2O + Cl2↑ 22.4 3Cl2 + 2NH4+ + 8OH-== 6Cl- + N2 + 8H2O
MnCl2 + 2H2O + Cl2↑ 22.4 3Cl2 + 2NH4+ + 8OH-== 6Cl- + N2 + 8H2O
【解析】
粗盐水中含有Ca2+、NH4+等杂质,Ca2+可采用沉淀法除去,加入沉淀剂使Ca2+转化为难溶物碳酸钙,应注意除杂时不能引进新的杂质粒子,因此沉淀剂应采用碳酸钠;NH4+可采用氧化还原法除去,过滤后向盐水中通入氯气,使NH4+发生氧化还原反应转化为氮气。
(1)Ca2+可采用沉淀法除去,加入沉淀剂使Ca2+转化为难溶物碳酸钙,因此试剂a为Na2CO3;
(2)试剂a中的CO32—与粗盐水中的Ca2+发生反应Ca2++CO32—=CaCO3↓,因此盐泥的主要成分为CaCO3;
(3)实验室采用MnO2与浓盐酸混合加热制取少量Cl2的化学方程式为:MnO2 + 4HCl(浓)![]() MnCl2 + 2H2O + Cl2↑;
MnCl2 + 2H2O + Cl2↑;
(4)根据方程式MnO2 + 4HCl(浓)![]() MnCl2 + 2H2O + Cl2↑可知,若1 mol MnO2完全反应,则生成1mol Cl2,转化为标准状况下的体积为1mol ×22.4L/mol=22.4L;
MnCl2 + 2H2O + Cl2↑可知,若1 mol MnO2完全反应,则生成1mol Cl2,转化为标准状况下的体积为1mol ×22.4L/mol=22.4L;
(5)在碱性条件下Cl2将NH4+氧化为N2,而Cl2被还原为Cl-,因此粒子反应方程式为: 3Cl2 + 2NH4+ + 8OH-== 6Cl- + N2 + 8H2O。