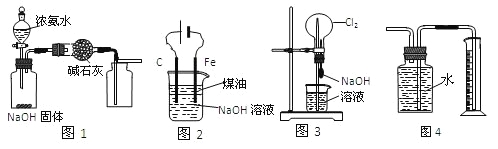
��Ŀ����
����Ŀ���ס��ҡ������ֻ���������⡢��������ͭ����Ԫ��������Ԫ����ɡ������£�����һ�ֺ�����������Ϊ87.5%��Һ̬�������Է��������������ij����Ҫ�ɷݵ���Է���������ͬ���Һͱ���ͭ�����ֳ���������������Ƶ�������ͭ����ȩ��Ӧ�Ļ�ԭ����Իش��������⣺
��1���Ľṹʽ___��
��2���ͱ���Ӧ�IJ����к����Һ�һ����̬���ʣ�д���仯ѧ����ʽ___��
��3�����ҹ����м�����������ữ����������Һ���ҹ�����ȫ�ܽ⣬�õ�����Һ��
��д�������ӷ���ʽ___��
����������Һ������Ũ�Ⱦ�ԼΪ0.1molL-1���������û��Һ�мӱ������ȵõ�___����(��ͬŨ�ȵĽ������ӿ�ʼ����ȫ���������������pH��ͼ)��

�����������Һ�����л���ȡ��(RH)������Ӧ��2RH(�л���)+Cu2+(ˮ��)R2Cu(�л���)+2H+(ˮ��)����֪��������������л��ﲻ�ܷ�����Ӧ��Ҳ�����ܡ������ʵ����֤�л����к���ͭԪ��___��
���𰸡�![]() N2H4+4CuO=2Cu2O+N2��+2H2O Cu2O+2Fe3++2H+=2Cu2++2Fe2++H2O Fe(OH)3 ȡ�л��㣬���������ϡ���ᣬ��ˮ�����ɫ����֤���л����к���ͭԪ��
N2H4+4CuO=2Cu2O+N2��+2H2O Cu2O+2Fe3++2H+=2Cu2++2Fe2++H2O Fe(OH)3 ȡ�л��㣬���������ϡ���ᣬ��ˮ�����ɫ����֤���л����к���ͭԪ��
��������
�����£�����һ�ֺ�����������Ϊ![]() ��Һ̬�������Է��������������ij����Ҫ�ɷݵ���Է���������ͬ����Ϊ��������Ҫ�ɷ�Ϊ�����͵��������Ըû��������Է�������Ϊ32��ͭ�����ֳ����������ǣ�CuO��Cu2O���������Ƶ�������ͭ����ȩ��Ӧ�Ļ�ԭ���������Cu2O������CuO�������ữ����������Һ��Cu2O��Ӧ�����ӷ���ʽΪ��Cu2O+2Fe3++2H+=2Cu2++2Fe2++H2O��������ҺKsp�ж���Һ�е�Ũ�Ⱦ�ԼΪ0.1molL-1Fe2+��Fe3+��Cu2+���������ӣ���һ����Ҫ�����������ӵ�Ũ��ԽС(pHԽС)����һ���ȳ��ֳ�����
��Һ̬�������Է��������������ij����Ҫ�ɷݵ���Է���������ͬ����Ϊ��������Ҫ�ɷ�Ϊ�����͵��������Ըû��������Է�������Ϊ32��ͭ�����ֳ����������ǣ�CuO��Cu2O���������Ƶ�������ͭ����ȩ��Ӧ�Ļ�ԭ���������Cu2O������CuO�������ữ����������Һ��Cu2O��Ӧ�����ӷ���ʽΪ��Cu2O+2Fe3++2H+=2Cu2++2Fe2++H2O��������ҺKsp�ж���Һ�е�Ũ�Ⱦ�ԼΪ0.1molL-1Fe2+��Fe3+��Cu2+���������ӣ���һ����Ҫ�����������ӵ�Ũ��ԽС(pHԽС)����һ���ȳ��ֳ�����
�ס��ҡ������ֻ���������⡢��������ͭ����Ԫ��������Ԫ����ɣ������£�����һ�ֺ�����������Ϊ![]() ��Һ̬�������Է��������������ij����Ҫ�ɷݵ���Է���������ͬ������������Ҫ�ɷ�Ϊ�����͵�������Ϊ����������Է�������Ϊ28��û�з������ʣ���Ϊ����������Է�������Ϊ32����û����ﺬN������Ϊ
��Һ̬�������Է��������������ij����Ҫ�ɷݵ���Է���������ͬ������������Ҫ�ɷ�Ϊ�����͵�������Ϊ����������Է�������Ϊ28��û�з������ʣ���Ϊ����������Է�������Ϊ32����û����ﺬN������Ϊ![]() �������N��H����Ԫ�أ�����ʽΪ
�������N��H����Ԫ�أ�����ʽΪ![]() ���Һͱ���ͭ�����ֳ���������������Ƶ�������ͭ����ȩ��Ӧ�Ļ�ԭ�������Ϊ
���Һͱ���ͭ�����ֳ���������������Ƶ�������ͭ����ȩ��Ӧ�Ļ�ԭ�������Ϊ![]() ����ΪCuO��
����ΪCuO��
![]() ��Ϊ
��Ϊ![]() ���ṹʽΪ
���ṹʽΪ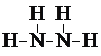 ��
��
�ʴ�Ϊ��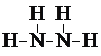 ��
��
![]() �ͱ���Ӧ�IJ����к����Һ�һ����̬���ʣ������嵥��Ϊ��������Ӧ�ķ���ʽΪ��
�ͱ���Ӧ�IJ����к����Һ�һ����̬���ʣ������嵥��Ϊ��������Ӧ�ķ���ʽΪ��![]() ��
��
�ʴ�Ϊ��![]() ��
��
![]() ��
��![]() �����м�����������ữ����������Һ��
�����м�����������ữ����������Һ��![]() ������ȫ�ܽ⣬�õ�����Һ��Ӧ��������ͭ������������
������ȫ�ܽ⣬�õ�����Һ��Ӧ��������ͭ������������
![]() ��Ӧ�����ӷ���ʽΪ��
��Ӧ�����ӷ���ʽΪ��![]() ��
��
�ʴ�Ϊ��![]() ��
��
![]() ��Ӧ����������������ͼ���֪
��Ӧ����������������ͼ���֪![]() ��ȫ����ʱ����pH��С�������CuO����������ʱ����ҺpH�����������������ij�����
��ȫ����ʱ����pH��С�������CuO����������ʱ����ҺpH�����������������ij�����![]() ��
��
�ʴ�Ϊ��![]() ��
��
![]() �ɿ��淴Ӧ
�ɿ��淴Ӧ![]() �л���
�л���![]() ˮ��
ˮ��![]() �л���
�л���![]() ˮ��
ˮ��![]() ��֪�������л����м��������ϡ���ᣬ��ƽ���������ƶ�������Һ�����ɫ����˵���л����к���
��֪�������л����м��������ϡ���ᣬ��ƽ���������ƶ�������Һ�����ɫ����˵���л����к���![]() ��
��
�ʴ�Ϊ��ȡ�л��㣬���������ϡ���ᣬ��ˮ�����ɫ����֤���л����к���ͭԪ�ء�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��ˮ�Ǽ����ĵ���ʣ��ı��¶Ȼ����ijЩ����ʻ�Ӱ��ˮ�ĵ��롣��ش��������⣺
(1)��ˮ�� 100��ʱ��pH��6�����¶��� 0.1molL��1 �� NaOH ��Һ�У���Һ�� pH��_____��
(2)25��ʱ����ˮ�м�������̼���ƹ������õ� pH Ϊ 11 ����Һ����ˮ������ӷ���ʽΪ_____�� ��ˮ������� c(OH��)��_____molL��1��
(3)�����Ϊ 100mL��pH ��Ϊ 2 ��������һԪ�� HX����ˮϡ������ pH ����Һ����Ĺ�ϵ��ͼ��ʾ���� HX ��_____(����ǿ��������������)��������_____��

(4)����ƽ�ⳣ���Ǻ���������ʵ���̶�ǿ������������
��ѧʽ | ���볣��(25��) |
HCN | K��4.9��10��10 |
CH3COOH | K��1.8��10��5 |
H2CO3 | K1��4.3��10��7��K2��5.6��10��11 |
��25��ʱ����Ũ�ȵ� NaCN ��Һ��Na2CO3 ��Һ�� CH3COONa ��Һ��pH �ɴ�С��˳��Ϊ________(�ѧʽ)��
��25��ʱ���� 0.5mol/L �Ĵ�����Һ���ɴ��������� c(H+)Լ����ˮ������� c(H+)��_________����