题目内容
合成氨工业中,原料气(N2、H2及少量的CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(Ⅰ)溶液来吸收原料气中的CO,其反应是:[Cu(NH3)2CH3COO]+CO+NH3 [Cu(NH3)3]CH3COO·CO(正反应为放热反应)
[Cu(NH3)3]CH3COO·CO(正反应为放热反应)
(1)必须除去原料气中的CO的原因是 。
(2)醋酸二氨合铜(Ⅰ)溶液吸收CO的生产适宜条件是 。
(3)吸收CO后的醋酸铜氨溶液经过适当处理又可再生,恢复其吸收CO的能力以供循环使用,醋酸铜氨溶液再生的适宜条件是 。
(1)防止合成塔中的催化剂中毒
(2)低温、高压
(3)高温、低压
解析

由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引用了各界的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g),该反应的能量变化如图所示:
CH3OH(g)+H2O(g),该反应的能量变化如图所示: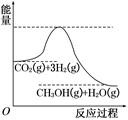
(1)上述反应平衡常数K的表达式为 ,温度降低,平衡常数K (填“增大”、“不变”或“减小”)。
(2)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。从反应开始到5 min末,用氢气浓度变化表示的平均反应速率v(H2)= 。
| t/min | 0 | 2 | 5 | 10 | 15 |
| n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
(3)下列条件能使上述反应的反应速率增大,且平衡向正反应方向移动的是 (填写序号字母)
a.及时分离出CH3OH气体
b.适当升高温度
c.保持容器的容积不变,再充入1 mol CO2和3 mol H2
d.选择高效催化剂
钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。
请回答下列问题:
(1)Ti的原子序数为22,Ti位于元素周期表中第_______周期,第______族。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2·x H2O,再经焙烧制得。水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因: 。
(4)由TiCl4→Ti 需要在Ar气中进行的理由是_________________________________。反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
| | TiCl4 | Mg | MgCl2 | Ti |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
 (5)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g) CH3OH(g)。
(5)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g) CH3OH(g)。①已知该反应在300oC时的化学平衡常数为0.27,该温度下将2mol CO、3mol H2和2mol CH3OH充入容积为2L的密闭容器中,此反应将 (填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
②若不考虑生产过程中物质的任何损失,上述产业链中每合成6 mol甲醇,至少需额外补充H2 mol。
已知下列两个反应:
反应Ⅰ:CO2(g)+H2(g)  CO(g)+H2O ΔH1
CO(g)+H2O ΔH1
反应Ⅱ:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH2
CO2(g)+H2(g) ΔH2
(1)相同温度下,若上述反应Ⅰ的化学平衡常数为K1,反应Ⅱ的化学平衡常数为K2,那么K1·K2=________。
(2)反应Ⅰ化学平衡常数K1和温度t的关系如下表一:
| t/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K1 | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
该反应的ΔH1__________0(选填“>”、“=”或“<”)。
(3)某温度下,反应Ⅰ的化学平衡常数为2.25。在该温度下,向甲、乙、丙三个恒容密闭容器中通入CO2(g)和H2(g),这两种物质的起始浓度如下表二:
| 起始浓度 | 甲 | 乙 | 丙 |
| c(CO2)(mol/L) | 0.01 | 0.02 | 0.02 |
| c(H2)(mol/L) | 0.01 | 0.01 | 0.02 |
反应速率最快的是________(填“甲”、“乙”或“丙”),平衡时,H2转化率最大的是________(填“甲”、“乙”或“丙”),丙中H2的转化率为________。
哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现将氢气和氮气充入某密闭容器中,在一定条件下反应的有关数据为:
| 项目 | H2 | N2 | NH3 |
| 起始时 | 5 mol·L-1 | 3 mol·L-1 | 0 |
| 2 s末 | 2 mol·L-1 | | |
(1)氢气和氮气反应生成氨气(在2 s内)的反应速率v(H2)=__________。若此时已达平衡,则可求得平衡常数为__________。
(2)下图表示合成NH3反应在时间t0→t6中反应速率与反应过程曲线图,则在下列达到化学平衡的时间段中,化学平衡常数最大的一段时间是__________。
①t0→t1 ②t2→t3 ③t3→t4 ④t5→t6
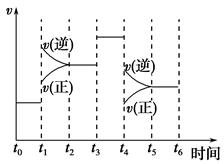
若t1时改变的条件是升高温度,则说明合成NH3反应的焓变ΔH________0(填“大于”或“小于”)。
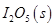 可用于检测CO,反应原理为:
可用于检测CO,反应原理为: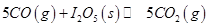
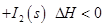 。向2L密闭容器中加入足量
。向2L密闭容器中加入足量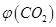 随时间的变化如下图所示。
随时间的变化如下图所示。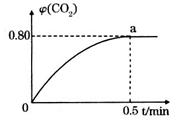
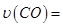 _____________。
_____________。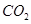 的体积分数
的体积分数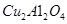 为催化剂,可以将
为催化剂,可以将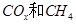 的混合气体直接转化为乙酸。
的混合气体直接转化为乙酸。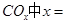 ______________。
______________。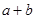 ________14(填“>”、“<”或“=”);该温度下醋酸的电离常数K=__________(用含a、b的式子表示)。
________14(填“>”、“<”或“=”);该温度下醋酸的电离常数K=__________(用含a、b的式子表示)。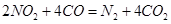 可以处理汽车尾气,若将该反应设计为原电池,用熔融Na2O作电解质,其正极电极反应式为________________________________。
可以处理汽车尾气,若将该反应设计为原电池,用熔融Na2O作电解质,其正极电极反应式为________________________________。 +2H2O。
+2H2O。 CH3OH(g)+H2O(g)能判断该反应已达化学反应限度标志的是 (填字母)。
CH3OH(g)+H2O(g)能判断该反应已达化学反应限度标志的是 (填字母)。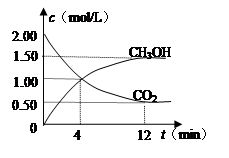
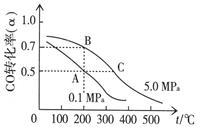
 CH3OH(g);已知密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率(α)与温度、压强的关系如右上图所示。
CH3OH(g);已知密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率(α)与温度、压强的关系如右上图所示。 cC(g) + dD(g) ,反应时间与C%(产物C的体积分数)函数关系如图所示。A图表示的是温度不同的曲线,B图表示压强不同的曲线,C图表示使用催化剂和不使用催化剂时的反应曲线。
cC(g) + dD(g) ,反应时间与C%(产物C的体积分数)函数关系如图所示。A图表示的是温度不同的曲线,B图表示压强不同的曲线,C图表示使用催化剂和不使用催化剂时的反应曲线。