题目内容
钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。
请回答下列问题:
(1)Ti的原子序数为22,Ti位于元素周期表中第_______周期,第______族。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2·x H2O,再经焙烧制得。水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因: 。
(4)由TiCl4→Ti 需要在Ar气中进行的理由是_________________________________。反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
| | TiCl4 | Mg | MgCl2 | Ti |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
 (5)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g) CH3OH(g)。
(5)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g) CH3OH(g)。①已知该反应在300oC时的化学平衡常数为0.27,该温度下将2mol CO、3mol H2和2mol CH3OH充入容积为2L的密闭容器中,此反应将 (填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
②若不考虑生产过程中物质的任何损失,上述产业链中每合成6 mol甲醇,至少需额外补充H2 mol。
(1)四;ⅣB(各1分)
(2)2FeTiO3+6C+7Cl2=2 FeCl3+2TiCl4+6CO(3分)
(3)TiCl4+(2+x)H2O TiO2·xH2O↓+4HCl,加入大量水并加热,促使水解趋于完全;(3分)
TiO2·xH2O↓+4HCl,加入大量水并加热,促使水解趋于完全;(3分)
(4)防止钛 、镁被氧化(或防止钛镁与空气、水反应),1412(各1分)
(5)①向逆反应方向进行②5(各2分)
解析试题分析:(1)Ti的原子序数为22,根据核外电子排布规律得Ti位于元素周期表中第四周期,第ⅣB元素;
(2)结合流程图,钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式为2FeTiO3+6C+7Cl2=2 FeCl3+2TiCl4+6CO
(3)TiCl4水解生成TiO2·xH2O化学方程式为TiCl4+(2+x)H2O TiO2·xH2O↓+4HCl,产物氯化氢易挥发,加入水并加热,氯化氢浓度减小,平衡一直正向进行,水解趋于完全;
TiO2·xH2O↓+4HCl,产物氯化氢易挥发,加入水并加热,氯化氢浓度减小,平衡一直正向进行,水解趋于完全;
(4)钛、镁易与空气中的氧气反应,得不到钛单质;反应后得到Mg、MgCl2、Ti的混合物,Mg、MgCl2的沸点都比钛的沸点低,所以温度只要略高于1412℃即可把Mg、MgCl2除去;
(5)该温度下CO、H2、CH3OH的浓度分别为1 mol/L、1.5 mol/L、1mol/L,其浓度商大于0.27,所以反应逆向进行;上述产业链中FeTiO3~7Cl2~6CO~6CH3OH,电解饱和食盐水得7Cl2~7H2,所以产链中6CH3OH~7H2,而由CO和H2合成甲醇反应中6CH3OH~12H2,所以生成6 mol甲醇,至少需额外补充H25mol。
考点:考查核外电子排布,化学方程式的书写,化学平衡理论的应用,电解原理的应用,分析计算能力

 阅读快车系列答案
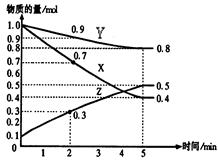
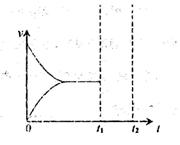
阅读快车系列答案某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如下图所示。
(1)由图中的数据分析,该反应的化学方程式为 ;
(2)反应开始至2min时Z的平均反应速率为 ;
(3)下列关于化学反应速率与化学反应限度的叙述不正确的是 ( )
| A.反应限度是一种平衡状态,此时反应已经停止 |
| B.达到平衡状态时,正反应速率和逆反应速率相等 |
| C.达到平衡状态时,反应物和生成物浓度都不再改变 |
| D.化学反应速率理论是研究怎样在一定时间内快出产品 |
(4)5min后曲线的含义 ;
一定温度下,在一个10 L密闭容器中发生某可逆反应,其平衡常数表达式为K= 。请回答下列问题。
。请回答下列问题。
(1)该反应的化学方程式为__________________________________________;
若温度升高,K增大,则该反应是________反应(填“吸热”或“放热”)。
(2)能判断该反应一定达到平衡状态的是________(填字母序号)。
| A.v正(H2O)=v逆(H2) |
| B.容器中气体的平均相对分子质量不随时间改变 |
| C.消耗n mol H2的同时消耗n mol CO |
| D.容器中物质的总物质的量不随时间改变 |

(4)实验测得t2时刻容器内有1 mol H2O(g),5 min后H2O(g)的物质的量是0.8 mol,这5 min内H2O(g)的平均反应速率为________。
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是( )
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,各物质浓度随时间变化的关系如图1所示。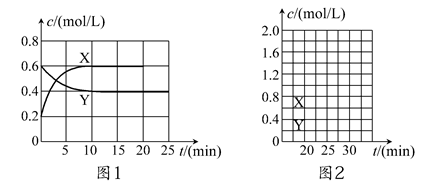
请回答:
(1)图l中,曲线________(填“X”或“Y”)表示NO2浓度随时间的变化情况;前10 min内v(NO2)=________mol/(L·min)。
(2)下列选项中不能说明该反应已达到平衡状态的是________(填选项字母)。
| A.容器内混合气体的压强不随时间变化而改变 |
| B.容器内混合气体的密度不随时间变化而改变 |
| C.容器内混合气体的颜色不随时间变化而改变 |
| D.容器内混合气体的平均相对分子质量不随时间变化而变化 |
(4)反应进行到20 min时,再向容器内充入一定量NO2,10 min后达到新的平衡,此时测得c(NO2)=0.9 mol/L。
①第一次平衡时混合气体中NO2的体积分数为ω1,达到新平衡后混合气体中NO2的体积分数为ω2,则ω1________ω2(填“>”、“=”或“<”);
②请在图2中画出20 min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和“Y”)。
 Ph—CH=CH2(g)+H2(g) △H
Ph—CH=CH2(g)+H2(g) △H
 [Cu(NH3)3]CH3COO·CO(正反应为放热反应)
[Cu(NH3)3]CH3COO·CO(正反应为放热反应) 2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
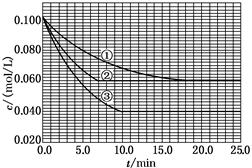
 C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100 mol/L、c(B)=0.200 mol/L及c(C)=0 mol/L。反应物A的浓度随时间的变化如下图所示。
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100 mol/L、c(B)=0.200 mol/L及c(C)=0 mol/L。反应物A的浓度随时间的变化如下图所示。