题目内容
1mol分子组成为C3H8O的液态有机化合物A,与足量的金属钠作用,可生成11.2L(标准状况)氢气,则A分子中必有一个 基,若此基在碳链的一端,且A中无支链,则A的结构简式为 ;A与浓硫酸共热,分子内脱去1分子水,生成B,B的结构简式为 ;B通入溴水能发生加成反应,生成C,C的结构简式为 ;A在有铜做催化剂时,与氧气一起加热,发生氧化反应,生成D,D的结构简式为 .
写出下列指定反应的化学方程式:A→B .B→C .A→D .
写出下列指定反应的化学方程式:A→B
考点:有关有机物分子式确定的计算
专题:烃及其衍生物的燃烧规律
分析:n(H2)=
=0.5mol,该有机物为丙醇,若羟基在碳链的一端,且A中无支链,A应为CH3CH2CH2OH,在浓硫酸作用下可生成CH3CH=CH2,CH3CH=CH2与溴水发生加成反应可生成CH3CHBrCH2Br,CH3CH2CH2OH,发生催化氧化可生成CH3CH2CHO,以此解答该题.
| 11.2L |
| 22.4L/mol |
解答:
解:1mol分子组成为C3H8O的液态有机物A,与足量的金属钠作用,可生成11.2L氢气,n(H2)=
=0.5mol,该有机物为丙醇,含有1个-OH;
若羟基在碳链的一端,且A中无支链,应为CH3CH2CH2OH,在浓硫酸作用下可生成B为CH3CH=CH2,A→B反应的方程式为:CH3CH2CH2OH
CH3CH=CH2↑+H2O;
B为CH3CH=CH2,与溴水发生加成反应可生成C为CH3CHBrCH2Br,B→C反应的方程式为:CH3CH=CH2+Br2→CH3CHBrCH2Br;
A为CH3CH2CH2OH,发生催化氧化可生成D为CH3CH2CHO,A→D反应的方程式为:2CH3CH2CH2OH+O2
2CH3CH2CHO+2H2O,
故答案为:羟;CH3CH2CH2OH;CH3CH=CH2;CH3CHBrCH2Br;CH3CH2CHO;
CH3CH2CH2OH
CH3CH=CH2↑+H2O;
CH3CH=CH2+Br2→CH3CHBrCH2Br;
2CH3CH2CH2OH+O2
2CH3CH2CHO+2H2O.
| 11.2L |
| 22.4L/mol |
若羟基在碳链的一端,且A中无支链,应为CH3CH2CH2OH,在浓硫酸作用下可生成B为CH3CH=CH2,A→B反应的方程式为:CH3CH2CH2OH
| 浓硫酸 |
| △ |
B为CH3CH=CH2,与溴水发生加成反应可生成C为CH3CHBrCH2Br,B→C反应的方程式为:CH3CH=CH2+Br2→CH3CHBrCH2Br;
A为CH3CH2CH2OH,发生催化氧化可生成D为CH3CH2CHO,A→D反应的方程式为:2CH3CH2CH2OH+O2
| Cu |
| △ |
故答案为:羟;CH3CH2CH2OH;CH3CH=CH2;CH3CHBrCH2Br;CH3CH2CHO;
CH3CH2CH2OH
| 浓硫酸 |
| △ |
CH3CH=CH2+Br2→CH3CHBrCH2Br;
2CH3CH2CH2OH+O2
| Cu |
| △ |
点评:本题考查有机物的推断、常见有机物的性质与转化,题目难度中等,注意对基础知识的理解掌握.

练习册系列答案
相关题目
某种橡胶的分解产物为碳氢化合物,对这种碳氢化合物作如下实验:①若取一定量完全燃烧,使燃烧后的气体通过干燥管,干燥管增重0.72g,再通过石灰水,石灰水增重2.2g.②经测定,该碳氢化合物(气体)的密度是相同条件下氢气密度的34倍.③该碳氢化合物0.1mol能和32g溴起加成反应.④经分析,在③的生成物中,溴原子分布在不同的碳原子上,且溴代物中有一个碳原子在支链上.下列说法正确的是( )
| A、该碳氢化合物为2-甲基-1,3-戊二烯 |
| B、该碳氢化合物与溴单质1:1加成时可以生成3种不同的产物 |
| C、该碳氢化合物与溴单质1:1加成时可以生成2种不同的产物 |
| D、该碳氢化合物与足量氢气加成时可以生成正戊烷 |
正确掌握化学用语和化学基本概念是学好化学的基础.下列有关表述中正确的一组是( )
| A、16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体 |
| B、SiH4、PH3、HCl的稳定性逐渐增强 |
| C、氧化铁的化学式:FeO |
D、Ca2+的结构示意图为 ,NH4Cl的电子式为 ,NH4Cl的电子式为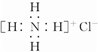 |
将一定量的锌放入100mL 18.4mol/L的浓硫酸中加热,充分反应后锌完全溶解,同时生成22.4L标况下的气体X,将反应后的溶液稀释至0.8L,测得溶液中H+浓度为0.1mol/L,则下列判断正确的是( )
| A、气体X为SO2 |
| B、气体X为H2 |
| C、气体X为SO2和H2的混合物 |
| D、气体X中SO2和H2的体积相等 |
硅是带来人类文明的重要元素之一,下列有关说法错误的是( )
| A、水泥、陶瓷、玻璃是三大重要的硅酸盐产品 |
| B、水玻璃是建筑行业经常使用的一种黏合剂 |
| C、刚玉、水晶、石英的主要成分是二氧化硅 |
| D、晶体硅是一种重要的半导体材料 |

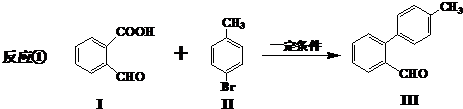
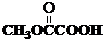 与
与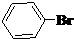 也可以发生类似反应①的反应,有机产物的结构简式为:
也可以发生类似反应①的反应,有机产物的结构简式为: