题目内容
【题目】“洁净煤技术”研究在世界上相当普遍.
(1)科研人员通过向地下煤层(焦炭)气化炉中鼓入水蒸气的方法,连续产出了高热值 的煤炭气,其主要成分是CO和H2 .
已知:H2(g)+ ![]() O2(g)═H2O(g)△H1=﹣241.8kJmol﹣1
O2(g)═H2O(g)△H1=﹣241.8kJmol﹣1
C(s)+ ![]() O2(g)═CO(g)△H2=﹣110.5kJmol﹣1
O2(g)═CO(g)△H2=﹣110.5kJmol﹣1
则生产煤炭气的热化学方程式为
(2)CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g)CH3OH(g). 在2L密闭容器中充有10mol CO与20mol H2 , CO的平衡转化率与温度、压强的关系如图所示.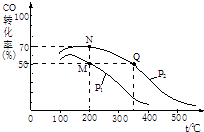
①关于上述反应在化学平衡状态时的描述正确的是 .
A.CO的含量保持不变
B.v正(CO)=v正(CH3OH)
C.容器中混合气体的平均相对分子质量保持不变
②该图像中P1P2(填“>”、“=”或“<”);
该反应逆反应的△H0 (填“>”、“=”或“<”).
③该反应的化学平衡常数表达式为K= , M、N、Q三点的平衡常数KM、KN、KQ的大小关系为 .
④M,N两点平衡状态下,容器中总物质的量之比为:n(M)总:n(N)总= .
(3)已知在常温常压下: ①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=﹣1275.6kJ/mol
②2CO(g)+O2(g)═2CO2(g)△H=﹣566.0kJ/mol
③H2O(g)═H2O(l)△H=﹣44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
【答案】
(1)C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ?mol﹣1
(2)ABC;<;<;![]() ;KM=KN>KQ;10:7
;KM=KN>KQ;10:7
(3)CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=﹣442.8kJ∕mol
【解析】解:(1)①H2(g)+ ![]() O2(g)═H2O(g)△H1=﹣241.8kJmol﹣1②C(s)+
O2(g)═H2O(g)△H1=﹣241.8kJmol﹣1②C(s)+ ![]() O2(g)═CO(g)△H2=﹣110.5kJmol﹣1②﹣①得到:C(s)+H2O(g)=CO(g)+H2(g),根据盖斯定律得到△H=﹣110.5kJmol﹣1+241.8kJmol﹣1=+131.3kJmol﹣1 ,
O2(g)═CO(g)△H2=﹣110.5kJmol﹣1②﹣①得到:C(s)+H2O(g)=CO(g)+H2(g),根据盖斯定律得到△H=﹣110.5kJmol﹣1+241.8kJmol﹣1=+131.3kJmol﹣1 ,
则生产煤炭气的热化学方程式为C(s)+H2O(g)=CO(g)+H2(g),△H=+131.3kJmol﹣1 ,
所以答案是:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJmol﹣1;(2)①A.CO的含量保持不变是化学平衡的特征,故A正确;
B.v正(CO)=v正(CH3OH)可以说明正逆反应速率相等,达到了平衡,故B正确;
C.容器中混合气体的平均相对分子质量等于质量和物质的量的比值,质量始终守恒,物质的量会变化,所以混合气体的平均相对分子质量保持不变,说明反应达到了平衡,故C正确,故选ABC;②相同温度下,同一容器中,增大压强,平衡向正反应方向移动,则CO的转化率增大,根据图像知,p1小于p2 , 升高温度CO的转化率减小,平衡逆向移动,所以反应是放热反应,焓变小于零,
所以答案是:<;<;③化学平衡常数K= ![]() ,K只与温度有关,相同温度时其平衡常数相等,升高温度平衡向逆反应方向移动,其平衡常数减小,根据图像知,温度:M=N<Q,则若M、N、Q三点的平衡常数KM、KN、KQ的大小关系为KM=KN>KQ;
,K只与温度有关,相同温度时其平衡常数相等,升高温度平衡向逆反应方向移动,其平衡常数减小,根据图像知,温度:M=N<Q,则若M、N、Q三点的平衡常数KM、KN、KQ的大小关系为KM=KN>KQ;
所以答案是: ![]() ;KM=KN>KQ;④M点时,CO转化率为50%,则参加反应的n(CO)=10mol×50%=5mol,还剩余5molCO,根据方程式知,还剩余n(H2)=20mol﹣5mol×2=10mol,生成n(CH3OH)=5mol;N点时,CO转化率为80%,参加反应的n(CO)=10mol×80%=8mol,还剩余2molCO,根据方程式知,还剩余n(H2)=20mol﹣8mol×2=4mol,生成n(CH3OH)=8mol,所以容器中总物质的量之比为:n(M)总:n(N)总=(5+10+5)mol:(2+4+8)mol=10:7,
;KM=KN>KQ;④M点时,CO转化率为50%,则参加反应的n(CO)=10mol×50%=5mol,还剩余5molCO,根据方程式知,还剩余n(H2)=20mol﹣5mol×2=10mol,生成n(CH3OH)=5mol;N点时,CO转化率为80%,参加反应的n(CO)=10mol×80%=8mol,还剩余2molCO,根据方程式知,还剩余n(H2)=20mol﹣8mol×2=4mol,生成n(CH3OH)=8mol,所以容器中总物质的量之比为:n(M)总:n(N)总=(5+10+5)mol:(2+4+8)mol=10:7,
所以答案是:10:7;(3)①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=﹣1275.6kJmol﹣1②2CO(g)+O2(g)═2CO2(g)△H=﹣566.0kJmol﹣1③H2O(g)═H2O(l)△H=﹣44.0kJmol﹣1
根据盖斯定律,将已知反应 ![]() ×(①﹣②+③×4)得到CH3OH(l)+O2(g)=CO(g)+2H2O(l),所以该反应的△H=
×(①﹣②+③×4)得到CH3OH(l)+O2(g)=CO(g)+2H2O(l),所以该反应的△H= ![]() ×[(﹣1275.6kJ/mol)﹣(﹣566.0kJ/mol)+(﹣44.0kJ/mol)×4]=﹣442.8kJmol﹣1 , 即CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=﹣442.8kJmol﹣1 ,
×[(﹣1275.6kJ/mol)﹣(﹣566.0kJ/mol)+(﹣44.0kJ/mol)×4]=﹣442.8kJmol﹣1 , 即CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=﹣442.8kJmol﹣1 ,
所以答案是:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=﹣442.8kJmol﹣1 .
【考点精析】认真审题,首先需要了解化学平衡状态本质及特征(化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)),还要掌握化学平衡的计算(反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%)的相关知识才是答题的关键.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g) +Y(g)![]() 2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法不正确的是
A. 反应前2min的平均速率v(Z)=4.0×10-3mol/(L·min)
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)<v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大