��Ŀ����
ʵ���о����֣����ᷢ��������ԭ��Ӧʱ�������Ũ��Խϡ����Ӧ��ԭ�����е�Ԫ�صĻ��ϼ�Խ�͡�ijͬѧȡһ���������Ͻ���100mLijŨ�ȵ������ַ�Ӧ����Ӧ������������ų����ڷ�Ӧ���������Һ�У���μ���4mol��L��1������������Һ����������������Һ�����(mL)������ij��������ʵ���(mol)�Ĺ�ϵ��ͼ��ʾ��C��0����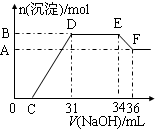
�Իش��������⣺
��1��д����Ӧ������DE�ε����ӷ�Ӧ����ʽ�� ��EF�����ɺ���Ԫ�����ӵ������� ��
��2���Ͻ��У���������Ϊ g����������Ϊ g ��
��3��C��ֵΪ mL��
��4��������Һ�����ʵ���Ũ��Ϊ mol��L��1��
��10�֣�������⣬����ÿ��2�֣���1�� NH4��+OH����NH3?H2O ��1�֣�
ƫ����������ǻ����������1�֣� ��2�� 0.216 1.344 ��3��7 ��4��1.48
���������������1��OC֮��û�г������ɣ�˵�����������OC֮�䷢���ķ�Ӧ����кͷ�Ӧ�����ӷ���ʽΪH++OH-��H2O��CD�����ڽ������������������Ƶķ�Ӧ���ֱ�����������������������������DEһ�γ�������û�з����仯��ΪNH4NO3��NaOH��Ӧ����Ӧ�����ӷ���ʽΪNH4��+OH����NH3?H2O��EF��Ϊ�������������������Ƶķ�Ӧ����Al(OH)3 +OH-��AlO2��+2H2O��Al(OH)3 +OH-��[Al(OH)4]�������EF�����ɺ���Ԫ�����ӵ�������ƫ����������ǻ����������
��2����ͼ��֪��EF�����ĵ�����������ҺΪ36mL��34m��2mL����ý��вμӷ�Ӧ����������Ϊ0.002L��4mol/L��0.008mol������Al(OH)3 +OH-��AlO2��+2H2O��֪��Al(OH)3�����ʵ���Ϊ0.008mol�������ԭ���غ��֪����������������0.008mol��27g/mol��0.216g��DE����������������Һ�������34ml��31ml��3mol������вμӷ�Ӧ����������Ϊ0.003L��4mol/L��0.012mol�����Ը��ݷ�ӦNH4��+OH����NH3?H2O��֪��NH4�������ʵ�����0.012mol�����ݵ�ԭ���غ��֪�����ɰ��������ʵ�����0.012mol�������ǻ�ԭ������Ը��ݵ��ӵ�ʧ�غ��֪���������ʵ�������0.012mol��8��0.008mol��3����3��0.024mol���������������0.024mol��56g/mol��1.344g��
��3�����ݷ�ӦʽFe3����3OH��=Fe(OH)3����Al3����3OH��=Al(OH)3����֪��C��D�������������Ƶ����ʵ�����0.024mol��3��0.008mol��3��0.096mol���������0.096mol��4mol/L��0.024L��24ml������C���Ӧ�������31ml��24ml��7ml��
��4��E���Ӧ�������������ƣ������������غ��֪�������Ƶ����ʵ�����0.034L��4mol/L��0.136mol�����Ը��ݵ�ԭ���غ��֪��ԭ��������ʵ�����0.136mol��0.012mol��0.148mol�����������Ũ����0.148mol��0.1L��1.48L��
���㣺�������������ķ�Ӧ���йؼ���

�ڻ�ƿ�м��롰�ʻ����ʼ��������ӳ��ʻ����������±���500mL���ʻ����ʼ�����Һ�к��еijɷ֣��Ķ���ش��������⣺
| �ɷ� | ������g�� | Ħ��������g ��mol��1�� |
| ���� | 25.0 | 342 |
| ����� | 0.3 | 174 |
| ��˾ƥ�� | 0.2 | 180 |
| ������� | 0.3 | 158 |
| ������ | 0.1 | 170 |
��1�����С��ʻ����ʼ����ijɷ��У����ڷǵ���ʵ���________��
A������ B������� C��������� D��������
��2��500mL���ʻ����ʼ����к���AgNO3�����ʵ���Ϊ_______mol��ֻ��ʽ�����������������ʻ����ʼ�����K+����˾ƥ�ֺ������в���K+�������ʵ���Ũ��Ϊ___________mol/L��
��ע�⣺�ڣ�2����ո�ֻҪ��д����ʽ������Ҫ��������㣩
��3�����ڲ��������������������������ʹ������ҺŨ��ƫ�͵���_________���������ţ�
������ƽ��ʹ�����룩����ʱ�����������������λ�÷ŵߵ���
�ڶ���ʱ���Ӷ���
����Һת�Ƶ�����ƿ���ձ���������δ������ˮϴ��
��ת����Һǰ����ƿ������������ˮ

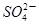 �����ʵ���Ũ��_____________mol��L��
�����ʵ���Ũ��_____________mol��L��