��Ŀ����
����Ŀ��X��Y��ZΪǰ������Ԫ����X��Yλ��ͬһ������X���������в���ȱ�ٵ�Ԫ��֮һ�������γɶ��ֻ�������̬ԭ������15�ֵ����˶�״̬.Y�ĸ�һ�����ӵ�����������������ĵ�������ͬ��Z�ǵ�������Ԫ�أ������ֻ��1�����ӣ�����������ԭ�ӹ�����������ӡ�
��1����̬X ԭ����������ռ�ݵ�����ܲ����Ϊ_____�����ܲ��е���ռ�ݵ�������ߵĵ������ڿռ���___����չ����ԭ�ӹ����_______��.
��2������X�뵥��Y2��Ӧ����������XY3��XY5�����и�ԭ�����������8�����ȶ��ṹ�Ļ������У�Xԭ�ӵ��ӻ��������Ϊ________������ӵĿռ乹��Ϊ________��
��3��Ԫ��Z��̬ԭ�ӵĺ�������Ų�ʽΪ______����ͬ����Ԫ���У���һ��������С����____��дԪ�ط��ţ���
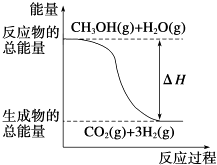
��4��Z��Y�γɵ�һ�ֻ����������������ͼ��ʾ.

�ٸþ����У�����____��Yԭ�����û�����Ļ�ѧʽΪ_____���辧���ⳤΪanm����˾����ܶ�Ϊ____g/cm3��д���������ʽ��Ħ��������M��ʾ������٤��������NA��ʾ��
�ڸû�����������ˮ�������ڰ�ˮ����ԭ����_________��
���𰸡� M 3 ���� sp3 ������ 1s22s22p63s23p63d104s1 K 4 CuC1 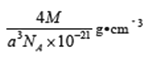 Cu+���백�γ�������ˮ����λ������
Cu+���백�γ�������ˮ����λ������
��������X���������в���ȱ�ٵ�Ԫ��֮һ�������γɶ��ֻ����������̬ԭ������15�ֵ����˶�״̬��˵��Xԭ�Ӻ�����15�����ӣ���X��PԪ�أ�X��Yλ��ͬһ������Y�ĸ�һ�����ӵ�����������������ĵ�������ͬ����Y��ClԪ�أ�Z�ǵ�������Ԫ�أ�˵��Z���ĸ����Ӳ㣬�����ֻ��1�����ӣ�����������ԭ�ӹ�����������ӣ�˵��Z��M����18�����ӣ���Z��CuԪ�ء�
(1). Pԭ�Ӻ�����15�����ӣ��������Ų������������ܲ㣬���Ե���ռ�ݵ�����ܲ����ΪM��Pԭ�ӵ������Ϊ3s23p3��p����ĵ���������ά�ռ�������x��y��z��3���������죬pԭ�ӹ��Ϊ�����Σ��ʴ�Ϊ��M��3�����壻
(2). ����P��Cl2��Ӧ����������PCl3��PCl5��PCl3��P��Clԭ�Ӿ����������8�����ȶ��ṹ��PCl3��Pԭ�ӵļ۲���Ӷ���Ϊ��3��![]() ��5��1��3��=4��Pԭ�ӵ��ӻ��������Ϊsp3����Pԭ���� 1���µ��Ӷԣ����Է��ӵĿռ乹��Ϊ�����Σ��ʴ�Ϊsp3����������
��5��1��3��=4��Pԭ�ӵ��ӻ��������Ϊsp3����Pԭ���� 1���µ��Ӷԣ����Է��ӵĿռ乹��Ϊ�����Σ��ʴ�Ϊsp3����������
(3). Z��CuԪ�أ����̬ԭ�ӵĺ�������Ų�ʽΪ1s22s22p63s23p63d104s1����ͬһ�����У�Ԫ�صĵ�һ��������ԭ�������ĵ�������������ƣ������ڵ��������У���һ��������С����KԪ�أ��ʴ�Ϊ��1s22s22p63s23p63d104s1��K��
(4). ��. ���ݾ����ṹ�����þ�̯��������ÿ�������к�����ԭ�ӵĸ���Ϊ��8��1/8��6��1/2=4��ͭԭ�ӵĸ���Ϊ��4��1=4�����Ըû�����Ļ�ѧʽΪCuCl��������������֪��1mol�����к���4molCuCl��1mol����������Ϊ4M�������ⳤΪanm�������ܶ�Ϊ��=![]()
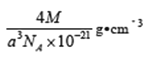 ���ʴ�Ϊ��4��CuCl��
���ʴ�Ϊ��4��CuCl��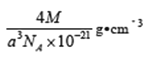 ��
��
��. ��Cu+���백�γ�������ˮ����λ���������CuCl������ˮ�������ڰ�ˮ���ʴ�Ϊ��Cu+���백�γ�������ˮ����λ�����

����Ŀ��ijѧϰС��ͨ������װ��̽��MnO2��FeCl3��6H2O�ܷ�Ӧ����Cl2��
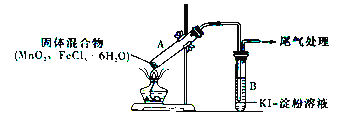
ʵ��������������±���ʾ��
ʵ���� | ���� | ���� |
ʵ��1 | ����ͼ��ʾװ�ü���MnO2��FeCl3��6H2O����� | ���Թ�A�в��ֹ����ܽ⣬�Ϸ����ְ��� ���Ժ�����ɫ���壬�ܱڸ��Ż�ɫҺ�� ���Թ�B����Һ���� |
ʵ��2 | ���Թ�A�еĻ���ﻻΪFeCl3��6H2O���Թ�B����Һ��ΪKSCN��Һ������ | �Թ�A�в��ֹ����ܽ⣬���������ͻ�ɫ���壻�Թ�B��KSCN��Һ��� |
��ش���������:
(1)ʵ��1��ʵ��2 ����������ԭ����_____________________________��
(2)ʵ��2˵����ɫ�����к���_____________(�ѧʽ)��
(3)Ϊ��һ��ȷ�ϻ�ɫ�������Ƿ���Cl2����ѧϰС���ʵ��1������ָĽ�����:
����1:���Թ�A��B������ʢ��ij���Լ���ϴ��ƿC������Թ�B ����Һ�Ա�Ϊ��ɫ��
����2:���Թ�B��KI-������Һ�滻ΪNaBr��Һ������Թ�B ����Һ�ʳȺ�ɫ����δ���Fe2+����1��ϴ��ƿC ��ʢ�ŵ��Լ���_________������2 �м���Fe2+���Լ���������______��ѡ��NaBr��Һ���Թ�B�з�������Ҫ��Ӧ�����ӷ���ʽΪ______________________________________��
(4)ʵ��1��ּ��Ⱥ������Թ�A�в������õ�Fe2O3 ��MnCl2�����Թ�A �в���Cl2 �Ļ�ѧ����ʽΪ__________________________________________����β�������ķ�����_______________________��
(5)��ѧϰС����Ϊʵ��1����Һ���������ܻ�������һ��ԭ����__________________���������ʵ�鷽����֤�˲���_______________________________________________��