题目内容
.下列事实不能用勒夏特列原理解释的是( )
| A.打开汽水瓶时,有大量气泡溢出 |
B.对2HI(g)  H2(g) + I2(g),增大平衡体系压强可使颜色变深 H2(g) + I2(g),增大平衡体系压强可使颜色变深 |
| C.在合成氨的反应中,为提高NH3的产率,采取高压的条件 |
D.溴水中有Br2 + H2O HBr + HBrO,当加入AgNO3溶液后,溶液颜色变浅 HBr + HBrO,当加入AgNO3溶液后,溶液颜色变浅 |
B
A:CO2(g) CO2(aq),打开汽水瓶时,压强减小,平衡左移,故有大量CO2气泡溢出;B:2HI(g)
CO2(aq),打开汽水瓶时,压强减小,平衡左移,故有大量CO2气泡溢出;B:2HI(g)  H2(g) + I2(g),两边气体系数不变,故增大平衡体系压强,平衡并没有移动,而体系颜色变深是因为I2(g)的浓度增大的缘故;C:合成氨反应是一个正反应气体系数减小的反应,增大压强,有利于提高氨气的产率;D:Br2 + H2O
H2(g) + I2(g),两边气体系数不变,故增大平衡体系压强,平衡并没有移动,而体系颜色变深是因为I2(g)的浓度增大的缘故;C:合成氨反应是一个正反应气体系数减小的反应,增大压强,有利于提高氨气的产率;D:Br2 + H2O HBr + HBrO,当加入AgNO3溶液后,HBr减小,平衡右移,导致Br2的浓度减小,溶液颜色变浅。
HBr + HBrO,当加入AgNO3溶液后,HBr减小,平衡右移,导致Br2的浓度减小,溶液颜色变浅。
 CO2(aq),打开汽水瓶时,压强减小,平衡左移,故有大量CO2气泡溢出;B:2HI(g)
CO2(aq),打开汽水瓶时,压强减小,平衡左移,故有大量CO2气泡溢出;B:2HI(g)  H2(g) + I2(g),两边气体系数不变,故增大平衡体系压强,平衡并没有移动,而体系颜色变深是因为I2(g)的浓度增大的缘故;C:合成氨反应是一个正反应气体系数减小的反应,增大压强,有利于提高氨气的产率;D:Br2 + H2O
H2(g) + I2(g),两边气体系数不变,故增大平衡体系压强,平衡并没有移动,而体系颜色变深是因为I2(g)的浓度增大的缘故;C:合成氨反应是一个正反应气体系数减小的反应,增大压强,有利于提高氨气的产率;D:Br2 + H2O HBr + HBrO,当加入AgNO3溶液后,HBr减小,平衡右移,导致Br2的浓度减小,溶液颜色变浅。
HBr + HBrO,当加入AgNO3溶液后,HBr减小,平衡右移,导致Br2的浓度减小,溶液颜色变浅。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 2YX3(g) △H
2YX3(g) △H 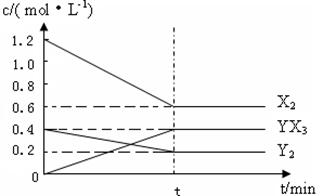
 2SO3,这是一个放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中,错误的是( )
2SO3,这是一个放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中,错误的是( ) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表: ,容积为2 L的球形容器,使压强为P,然后将整个容器用加热器加热到t℃时,发生如下反应:
,容积为2 L的球形容器,使压强为P,然后将整个容器用加热器加热到t℃时,发生如下反应: 2C(g);?H=-180 kJ·
2C(g);?H=-180 kJ·
 ·
· ,为了维持恒温t℃,平均每分钟需用加热器提供________kJ的热量;
,为了维持恒温t℃,平均每分钟需用加热器提供________kJ的热量;
 2SO3(g);△H= -197 kJ/ mol,当达到平衡状态时,下列说法中正确的是( )
2SO3(g);△H= -197 kJ/ mol,当达到平衡状态时,下列说法中正确的是( ) CH3OH(g)+H2O(g) +49.0 kJ。反应在2分钟时达到了平衡。
CH3OH(g)+H2O(g) +49.0 kJ。反应在2分钟时达到了平衡。
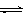 H+ + In—(aq)
H+ + In—(aq)