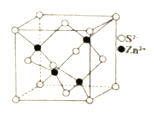
题目内容
【题目】(多选)汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3═K2O+5Na2O+16N2↑.若氧化产物比还原产物多1.75mol,则下列判断正确的是( )
A.生成42.0 L N2(标准状况)
B.转移电子的物质的量为1.25 mol
C.有0.250 mol KNO3被氧化
D.被氧化的N原子的物质的量为3.75 mol
【答案】BD
【解析】解:10NaN3+2KNO3═K2O+5Na2O+16N2↑中N元素化合价由﹣ ![]() 、+5价变为0价,所以NaN3是还原剂、KNO3是氧化剂,N2既是氧化产物又是还原剂,根据反应方程式可知,每当生成16molN2 , 则氧化产物比还原产物多14mol,转移电子的物质的量为10mol,被氧化的N原子的物质的量为30mol,有2molKNO3被还原,现氧化产物比还原产物多1.75mol,则生成2molN2 , 转移电子的物质的量为1.25mol,被氧化的N原子的物质的量为3.75mol,A.生成2molN2 , 在标准状况下的体积为44.8L,故A错误;
、+5价变为0价,所以NaN3是还原剂、KNO3是氧化剂,N2既是氧化产物又是还原剂,根据反应方程式可知,每当生成16molN2 , 则氧化产物比还原产物多14mol,转移电子的物质的量为10mol,被氧化的N原子的物质的量为30mol,有2molKNO3被还原,现氧化产物比还原产物多1.75mol,则生成2molN2 , 转移电子的物质的量为1.25mol,被氧化的N原子的物质的量为3.75mol,A.生成2molN2 , 在标准状况下的体积为44.8L,故A错误;
B.转移电子的物质的量为0.25mol×(5﹣0)=1.25mol,故B正确;
C.由反应可知,被还原的硝酸钾的物质的量为2mol× ![]() =0.25mol,故C错误;
=0.25mol,故C错误;
D.转移10mol电子被氧化的N原子为30mol,则转移1.25mol电子被氧化的N原子的物质的量为 ![]() mol=3.75mol,故D正确;
mol=3.75mol,故D正确;
故选BD.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目