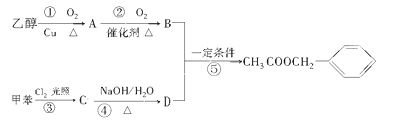
题目内容
【题目】为验证氧化性Cl2>Fe3+>SO2,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。
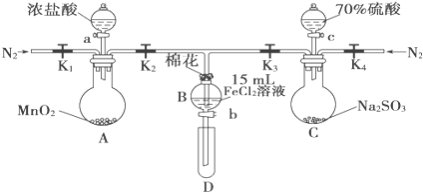
实验过程:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,关闭K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开K3和活塞c,加入70%的硫酸,一段时间后关闭K。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是__________________________。
(2)实验室在保存FeCl2溶液时为了防止FeCl2溶液变质,经常向其中加入铁粉,其原因是__________________________。
(3)若向第III步B中的黄色溶液中通入H2S气体,会观察到有淡黄色沉淀生成,写出该反应的化学方程式__________________________。
(4)若将制取的SO2通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的离子方程式为__________________________。
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示.他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是_____(填“甲”、“乙”或“丙”)。
过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有Fe2+ |
乙 | 既有Fe3+又有Fe2+ | 有SO42﹣ |
丙 | 有Fe3+无Fe2+ | 有SO42﹣ |
(6)将B中的FeCl2溶液换成100mLFeBr2溶液并向其中通入2.24LCl2(标准状况下),若溶液中有1/2的Br﹣被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为____。
【答案】排出装置中的空气,防止干扰 Fe2+容易被空气中的氧气氧化,铁粉可以将氧化得到的Fe3+还原为Fe2+ 2FeCl3+H2S=2FeCl2+2HCl+S↓ 2MnO4-+5SO2+2H2O=2Mn 2+ +5SO42- +4H+ 甲、乙 1mol/L
【解析】
(1)通入一段时间N2,排出装置中的氧气;
(2)Fe2+被空气中的O2氧化变为Fe3+,若加入Fe粉,会发生氧化还原反应产生Fe2+;
(3)第Ⅲ步B中发生+3铁离子与硫化氢反应,生成硫沉淀、+2亚铁离子、盐酸;
(4)SO2通入酸性高锰酸钾溶液中二者可以发生氧化还原反应;
(5)乙中第一次,说明氯气不足,氯气氧化性大于铁离子,第二次有硫酸根离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫,甲中第一次有Fe3+,无Fe2+,则氯气的氧化性大于铁离子,第二次有亚铁离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫;
(6)根据电子守恒进行计算。
(1)打开K1~K4,关闭K5、K6,通入一段时间N2,目的是排出装置中的空气,防止其氧化Fe2+,干扰实验;
(2)Fe2+被空气中的O2氧化变为Fe3+,若加入还原铁粉,会发生反应:2Fe3++Fe=3Fe2+,从而可以起到防止Fe2+变质的作用;
(3) Fe3+具有强的氧化性,可以与H2S反应,生成S单质、Fe2+、盐酸,反应的化学方程式为:2FeCl3 +H2S=2FeCl2 +2HCl +S↓;
(4)SO2具有还原性,酸性高锰酸钾溶液具有强的氧化性,二者混合反应反应,SO2被氧化成硫酸,KMnO4被还原变为MnSO4,根据电子守恒、电荷守恒及原子守恒,可得离子方程式为2MnO4-+5SO2 +2H2O=2Mn2++5SO42- +4H+;
(5)乙中第一次,说明氯气不足,氯气氧化性大于铁离子,第二次有硫酸根离子,说明发生SO2与Fe3+的反应,则氧化性:Fe3+> SO2,甲中第一次有Fe3+,无Fe2+,则氧化性:Cl2>Fe3+,第二次有Fe2+,说明发生SO2与Fe3+的反应,则氧化性:Fe3+> SO2,故答案为:甲、乙;
(6)设FeBr2的物质的量浓度为c,根据电子守恒可知,![]() ,解得c=1mol/L。
,解得c=1mol/L。

【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
B | 向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
C | 向CuSO4溶液中加入铁粉,有红色固体析出 | Fe2+的氧化性强于Cu2+的氧化性 |
D | 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl) >Ksp(AgI) |
A. A B. B C. C D. D
【题目】(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。那么用太阳能分解10mol水消耗的能量是____________kJ;
(2)由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:
(i)CO(g) + 2H2(g) = CH3OH(g) △H1 = -90.1kJmol-1
(ii)CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H2 = -49.0kJmol-1
水煤气变换反应:
(iii)CO(g) + H2O(g) = CO2(g) + H2 (g) △H3 = -41.1kJmol-1
二甲醚合成反应:
(iV)2 CH3OH(g) = CH3OCH3(g) + H2O(g) △H4 = -24.5kJmol-1
则由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为____________。
(3)在容积为1.00L的容器中,通入一定量N2O4,发生N2O4(g) ![]() 2NO2(g), 100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,v(N2O4)=_______________________,
2NO2(g), 100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,v(N2O4)=_______________________,
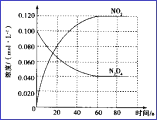
(4)已知反应2HI(g)=H2(g) + I2(g)的ΔH= +11kJ·mol-1,1molH2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为___________kJ。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数, 若k正 = 0.0027min-1,在t=40min时,v正=_______min-1
【题目】现有部分元素的原子结构特点如表:
X | L层电子数是K层电子数的3倍 |
Y | 核外电子层数等于原子序数 |
Z | L层电子数是K层和M层电子数之和 |
W | 最外层电子数是次外层电子数的2.5倍 |
(1)画出W原子结构示意图________________________。
(2)元素X与元素Z相比,非金属性较强的是________(填元素名称),写出一个能表示X、Z非金属性强弱关系的化学反应方程式:________________________________________。
(3)X、Y、Z、W四种元素形成的一种离子化合物,其水溶液显强酸性,该化合物的化学式为____________________。
(4)元素X和元素Y以原子个数比1∶1化合形成的化合物Q,写出Q的电子式________。元素W和元素Y化合形成的化合物M,Q和M的电子总数相等。以M为燃料,Q为氧化剂,可作火箭推进剂,最终生成无毒的、且在自然界中稳定存在的物质,写出该反应的化学方程式:____________________________________。