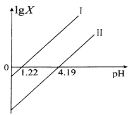
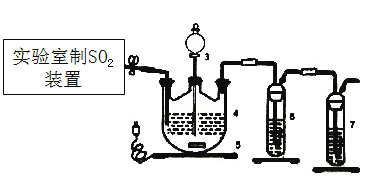
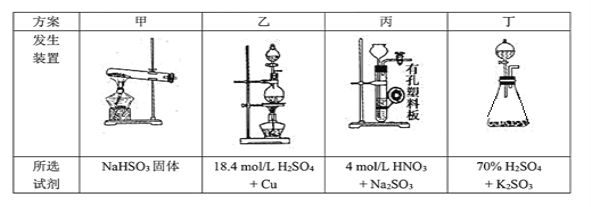
题目内容
【题目】向1.00L0.3mol/L的NaOH溶液中缓慢通入CO2气体至溶液增重8.8g,所得溶液中( )
A.溶质为Na2CO3
B.溶质为Na2CO3、NaHCO3
C.![]() c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
D.c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H+)
【答案】BD
【解析】
向1L0.3mol/L的NaOH溶液中缓缓通入CO2气体至溶液增重8.8g,则增重的8.8g为二氧化碳的质量,物质的量为0.2mol,发生反应CO2+NaOH=NaHCO3,CO2+2NaOH=Na2CO3+H2O,由于n(CO2):n(NaOH)=2:3=1:1.5,介于1:1~1:2之间,所以两个反应都发生,所得溶液中溶质为Na2CO3和NaHCO3,结合物料守恒与电荷守恒判断。
A.由上述分析可知,溶液为Na2CO3和NaHCO3,故A错误;
B.由上述分析可知,溶液为Na2CO3和NaHCO3,故B正确;
C.由碳元素守恒可知c(HCO3-)+c(CO32-)+c(H2CO3)=0.2mol/L,溶液中c(Na+)=0.3mol/L,所以![]() c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),故C错误;
c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),故C错误;
D.根据溶液电荷守恒c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),所以c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H+),故D正确。
故选:BD。

【题目】![]() 、
、![]() 、
、![]() 、
、![]() 是四种短周期元素,它们的核电荷数依次增大,四种元素的性质或原子结构的部分信息如表所示。
是四种短周期元素,它们的核电荷数依次增大,四种元素的性质或原子结构的部分信息如表所示。
元素 | 元素性质或原子结构的部分信息 |
| 元素的离子核外无电子 |
| 地壳中含量最多的元素 |
| 元素的离子半径在该周期中最小 |
|
|
下列叙述不正确的是( )
A.![]() 与
与![]() 形成的化合物在常温下为气体
形成的化合物在常温下为气体
B.![]() 的最高价氧化物对应的水化物不与
的最高价氧化物对应的水化物不与![]() 溶液反应
溶液反应
C.![]() 和
和![]() 形成的常见化合物能形成酸雨
形成的常见化合物能形成酸雨
D.简单氢化物的稳定性:![]()
【题目】根据下表回答下列问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ |
(1)写出下列元素符号:①______,⑥______,⑦______,⑨______。
(2)在这些元素中,最活泼的金属元素是______(填元素符号,下同),最活泼的非金属元素是______,最不活泼的元素是______。
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的是__________________,碱性最强的是__________________,呈两性的氢氧化物是__________________;三者之间相互反应的化学方程式是____________________________________。
(4)在这些元素(稀有气体元素除外)中,原子半径最小的是__________,原子半径最大的是____。
(5)在③与④中,化学性质较活泼的是__________,怎样用化学实验证明?______________ 在⑧与中,化学性质较活泼的是______,怎样用化学实验证明?________________________。
【题目】芜湖市某便利店销售的一种食用碘盐包装袋上有如下标签:
产品标准 | GB5461 |
产品等级 | 一级 |
配料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,请配平化学方程式:____KIO3+____KI+____H2SO4=____K2SO4+_____I2+____H2O
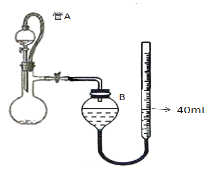
(2)实验室可分离获取单质碘,其实验操作可分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把适量碘水和CCl4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口玻璃塞是否漏液;
D.倒转漏斗,用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收下层溶液;
F.从分液漏斗的上口倒出上层水溶液;
G.将漏斗上口的玻璃塞打开;
H.静置、分层;
①正确的操作顺序是(用编号字母填写)____→____ → ___→A → __→ ___→E→F。
②下列物质,不能作为从水溶液中萃取碘的溶剂是____。
A.苯 B.汽油 C.酒精
(3)若向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。理论上Na2SO3与I2反应的物质的量之比为____。