题目内容
【题目】由Cu、N、B等元素组成的新型材料有着广泛用途。
(1)基态 Cu+ 的核外电子排布式为____________。在高温下CuO 能分解生成Cu2O,试从原子结构角度解释其原因:_______________________________。
(2)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,它属于____晶体。
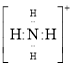
(3)化合物A (H3BNH3) 是一种潜在的储氢材料,它可由六元环状化合物 (HB=NH)3通过3CH4+ 2 (HB=NH)3+ 6H2O →3CO2 + 6H3BNH3 制得。
①与上述化学方程式有关的叙述不正确的是_________。(填标号)
A.反应前后碳原子的轨道杂化类型不变 |
B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形 |
C.第一电离能:N>O>C>B |
D.化合物A中存在配位键 |
②1个 (HB=NH)3分子中有__个σ键。
(4)在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为________。图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为_________。


【答案】[Ar]3d10 结构上Cu2+为3d9,而Cu+为3d10全充满更稳定 原子晶体 A 12 [BO2]nn-(或BO2-) sp2、sp3
【解析】
(1)Cu是29号元素。基态 Cu+ 的核外有28个电子。核外电子排布式为[Ar]3d10 ;在高温下CuO 能分解生成Cu2O,是因为CuO在变为Cu2O时,其中的Cu的结构由Cu2+的3d9变为3d10的全充满Cu+。更稳定的结构。
(2)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,它属于原子晶体。
(3)①A. 在反应前后CH4中的碳原子的轨道杂化类型是sp3杂化,在反应后CO2中的碳原子的轨道杂化类型是sp杂化。轨道杂化类型改变。错误。B. CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形。正确。C. 一般情况下,同一周期的元素,元素的非金属性越强,原子半径越小,第一电离能越大。但是由于N原子的核外电子是处于半充满的稳定状态,所以其第一电离能比O盐酸的还大。因此第一电离能大小关系是:N>O>C>B。正确。D. 在化合物A中的N原子上存在配位键。正确。②由H3BNH3的分子结构可知在1个(HB=NH)3分子中有12个σ键.
(4)由图(a)可知多硼酸根离子符号为BO2-或[BO2]nn-。由图(b)硼砂晶体可知:其中硼原子采取的杂化类型sp2、sp3 两种类型。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一,研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-53.7kJmol-1 I
CH3OH(g)+H2O(g) △H1=-53.7kJmol-1 I
CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2 II
CO(g)+H2O(g) △H2 II
某实验室控制CO2和H2初始投料比为1︰2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[备注]Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
(1)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是___。
(2)在如图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程-能量”示意图___。