��Ŀ����
����Ŀ����ѧ��ҵ�л��������������ˮ��ֱ���ŷŻ������Ⱦ��
��1����ҵ�ϴ������Ժ�Cr2O72����ˮ�ķ������£�
��SO2��ԭ������1000L��0.002molL��1 Cr2O72�������Է�ˮ��ͨ��SO2ʹCr2O72��ȫ��ת��ΪCr3+ �� ������Ҫͨ��L SO2����״����
����м��ԭ������Cr2O72�������Է�ˮ�м������м�����ȳ�ַ�Ӧ������ʯ�ҵ�����Һ��pH��ʹCr3+��ȫ������
��֪25��ʱ��Ksp[Cr��OH��3]=6.3��10��31 �� ��ʹ��Һ�в���Cr3+�����ʵ���Ũ��Ϊ6.3��10��7 molL��1 �� Ӧ������Һ��pH= ��
��2����Ԫ����Ũ�ȵIJⶨ��ȷ��ȡ20.00mL��Cr2O72����Cr3+�����Է�ˮ�������м���������NH4��2S2O8��Һ��Cr3+������Cr2O72�� �� ��г�ȥ������NH4��2S2O8����������Һ�м��������KI��Һ����ַ�Ӧ���Ե���Ϊָʾ���������еμ�0.03molL��1��Na2S2O3����Һ���յ�ʱ����Na2S2O3��Һ20.00mL��
���������������У�������в�������ⶨ�ĸ�Ԫ����Ũ�Ȼ� ��
�ڼ����ˮ�и�Ԫ����Ũ�ȣ���λ��mgL��1 �� д��������̣�
��֪�ⶨ�����з����ķ�Ӧ���£�
��2Cr3++3S2O82��+7H2O=Cr2O72��+6SO42��+14H+
��Cr2O72��+6I��+14H+=2Cr3++3I2+7H2O
��I2+2S2O32��=2I��+S4O62�� ��
���𰸡�
��1��134.4��6
��2��ƫ�ߣ�Cr2O72����3I2��6S2O32�� �� ���ݷ���ʽȷ����ϵCr2O72����3I2��6S2O32��
n��Cr2O72����= ![]() =
= ![]() mol������c��Cr2O72����=
mol������c��Cr2O72����= 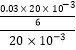 =0.005mol/L���Է�ˮ�и�Ԫ����Ũ��=0.005��2��52��1000=520 mg?L��1
=0.005mol/L���Է�ˮ�и�Ԫ����Ũ��=0.005��2��52��1000=520 mg?L��1
���������⣺��1����SO2ʹCr2O72��ȫ��ת��ΪCr3+ �� ����3SO2����Cr2O72�� ��
3��22.4L 1mol
V 1000L��0.002molL��1
����V= ![]() =134.4L�����Դ��ǣ�134.4��
=134.4L�����Դ��ǣ�134.4��
��Ksp[Cr��OH��3]=c��Cr3+��c3��OH����=6.3��10��31 �� ��ʹ��Һ�в���Cr3+�����ʵ���Ũ��Ϊ6.3��10��7 molL��1 �� ����c��OH����= ![]() =10��8mol/L��Ӧ������Һ��pOH=8����pH=6�����Դ��ǣ�6����2����������в������������NH4��2S2O8����Cr2O72�� �� ������ⶨ�ĸ�Ԫ����Ũ�Ȼ�ƫ�ߣ����Դ��ǣ�ƫ�ߣ�
=10��8mol/L��Ӧ������Һ��pOH=8����pH=6�����Դ��ǣ�6����2����������в������������NH4��2S2O8����Cr2O72�� �� ������ⶨ�ĸ�Ԫ����Ũ�Ȼ�ƫ�ߣ����Դ��ǣ�ƫ�ߣ�
���ɢ�2Cr3++3S2O82��+7H2O=Cr2O72��+6SO42��+14H+
��Cr2O72��+6I��+14H+=2Cr3++3I2+7H2O
��I2+2S2O32��=2I��+S4O62���ã�Cr2O72����3I2��6S2O32�� �� ���ݷ���ʽȷ����ϵCr2O72����3I2��6S2O32��
n��Cr2O72����= ![]() =
= ![]() mol������c��Cr2O72����=
mol������c��Cr2O72����= 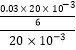 =0.005mol/L
=0.005mol/L
���Է�ˮ�и�Ԫ����Ũ��=0.005��2��52��1000=520 mgL��1 �� ��Cr2O72����3I2��6S2O32�� �� ���ݷ���ʽȷ����ϵCr2O72����3I2��6S2O32��
n��Cr2O72����= ![]() =
= ![]() mol������c��Cr2O72����=
mol������c��Cr2O72����= 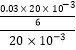 =0.005mol/L
=0.005mol/L
���Է�ˮ�и�Ԫ����Ũ��=0.005��2��52��1000=520 mgL��1 ��



