题目内容
【题目】将纯锌片和纯铜片插入同浓度的稀硫酸中一段时间,下列叙述正确的是
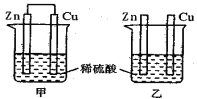
A. 甲中铜片是正极,乙中铜片是负极
B. 甲中铜被氧化,乙中锌被氧化
C. 产生气泡的速率甲比乙快
D. 两烧杯中铜片表面均无气泡产生
【答案】C
【解析】分析:甲为原电池,Zn比Cu活泼,Zn为负极,Zn被氧化,Cu为正极,Cu片表面产生气泡;乙不组成原电池,Zn与稀硫酸发生置换反应产生H2,Cu与稀硫酸不反应;形成原电池加快产生H2的速率。
详解:A项,甲为原电池,Zn比Cu活泼,Zn片为负极,Cu片为正极,乙不组成原电池,A项错误;B项,甲中Zn为负极,负极电极反应式为Zn-2e-=Zn2+,Cu为正极,Cu电极上的电极反应式为2H++2e-=H2↑,乙中Zn失电子,被氧化,反应的离子方程式为Zn+2H+=Zn2++H2↑,甲、乙中都是Zn被氧化,B项错误;C项,甲为原电池,乙不组成原电池,甲、乙中总反应都为Zn+2H+=Zn2++H2↑,产生气泡的速率甲比乙快,C项正确;D项,甲中Cu电极上的电极反应式为2H++2e-=H2↑,甲烧杯中Cu片表面有气泡产生,D项错误;答案选C。

练习册系列答案
相关题目