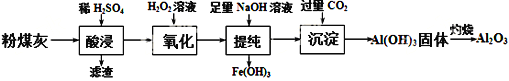
��Ŀ����
����Ŀ��ij������ȤС��̽�����÷�ͭм��ȡCuSO4��Һ����������¼���ʵ�鷽����
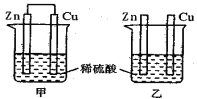
��1������һ����ͭ��Ũ���ᷴӦ�Ʊ�����ͭ��Һ��������������ͭм�ڿ��������պ���Ͷ��ϡ���ᣮ�ͷ���һ��ȣ����������ŵ�����
��2����������ʵ���У����������ײ����������Ϻ�ɫ���壬�ټ���ϡ������Ȼ���ܽ⣬�ù���Ϊ ��
��3����������ʵ��������ͼ1��ʾ���ܽ������������ų����������� �� ���ŷ�Ӧ�Ľ��У����������ٶȼӿ죬�Ʋ���ܵ�ԭ�� �� 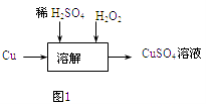
��4�����ʵ��֤������Ʋ� ��
��5�������ĵ�ʵ��������ͼ2��ʾ��Ϊ�˵õ��ϴ���������ͭ��Һ���������������ʵ���֮��ӦΪ �� 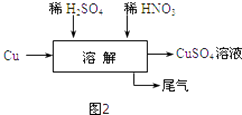
��6���Է����Ľ��в������ƣ����һ�����ܷ�ֹ��Ⱦ������ʵ������ѭ����ʵ�鷽����������ͼ��ʾ����
���𰸡�
��1����������Ⱦ������SO2���壬��ȡ������CuSO4��Һ�����ĵ���������
��2��Cu
��3��O2����Ӧ������Cu2+��H2O2�ֽ��д�����
��4��ȡH2O2��Һ�������еμ�CuSO4��Һ���۲�������ݵ������Ƿ�ӿ�
��5��3��2
��6��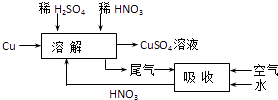
���������⣺��1������2������һ����һ�������зų����ж���������������ɶԿ�������Ⱦ���ڶ�������ͭ������������������ͭ������ͭ�����ᷴӦ��������ͭ��ˮ����˷�Ӧ������û����Ⱦ���ԭ�ϵ������ʸߣ���������ʵ���У����������ײ����������Ϻ�ɫ���壬Ϊͭ��������ϡ������Դ��ǣ���������Ⱦ������SO2���壬��ȡ������CuSO4��Һ�����ĵ��������٣�Cu��
��3.����������ʵ��������ͼ1�У�˫��ˮ��Ӧ������ԭ��Ӧ����O2�����ŷ�Ӧ�Ľ��У����������ٶȼӿ죬�����Ƿ�Ӧ������Cu2+��H2O2�ֽ��д����ã����Դ��ǣ�O2����Ӧ������Cu2+��H2O2�ֽ��д����ã�
��4.��ȡH2O2��Һ�������еμ�CuSO4��Һ������������ݵ����ʼӿ죬��֤��Cu2+��H2O2�ֽ��д����ã�����Cu2+��H2O2�ֽ�û�д����ã����Դ��ǣ�ȡH2O2��Һ�������еμ�CuSO4��Һ���۲�������ݵ������Ƿ�ӿ죻
��5.���������ӷ���ʽ��3Cu+2NO3��+8H+=3Cu2++2NO��+4H2O����Ӧ����2mol���ᣬ����3mol����ͭ����Ϊ�˵õ��ϴ���������ͭ��Һ���������������ʵ���֮��ӦΪ3��2�����Դ��ǣ�3��2��
��6.�����ʵ�鷽��ʱ��Ϊ��ֹNO��Ⱦ������Ӧͨ���������NOΪNO2 �� ��ˮ���պ�����HNO3��ѭ�����á�
���Դ��ǣ�  ��
��