题目内容
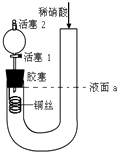
【题目】如图装置就用于实验室制取NH3 , 并用AlCl3溶液吸收多余氨气制氢氧化铝,最后回收氯化铵的实验,能达到实验目的是( )
A.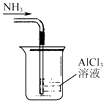
吸收NH3制取Al(OH)3
B.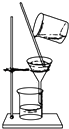
在不断搅拌下分离Al(OH)3和NH4Cl溶液
C.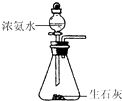
制取NH3
D.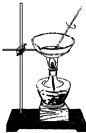
蒸干NH4Cl溶液并灼烧制NH4Cl
【答案】C
【解析】解:A.导管在液面下,易发生倒吸,则图中装置不能吸收氨气,应使导管在液面上,故A错误;
B.Al(OH)3和NH4Cl溶液可利用过滤法分离,但不能搅拌,易捣破滤纸,操作失败,故B错误;
C.浓氨水与CaO混合,可制备氨气,则图中固体与液体混合制取气体的装置合理,故C正确;
D.灼烧氯化铵分解,应蒸发、浓缩、冷却结晶制NH4Cl,故D错误;
故选C.

练习册系列答案
相关题目