题目内容
【题目】能正确表示下列反应的离子方程式是
A. 将饱和氯化铁溶液逐滴加入煮沸的蒸馏水中制备氢氧化铁胶体:Fe3+ + 3H2O ![]() Fe(OH)3↓+ 3H+
Fe(OH)3↓+ 3H+
B. 向FeBr2溶液中通入过量Cl2:2Fe2+ + 2Br- + 2Cl2 = 2Fe3++ Br2 + 4Cl-
C. 将NaHCO3溶液与过量的Ca(OH)2溶液混合:HCO3- + OH-+ Ca2+ = CaCO3↓+ H2O
D. 用KIO3氧化酸性溶液中的KI:5I- + IO3- + 3H2O = 3I2 + 6OH-
【答案】C
【解析】A.将饱和氯化铁溶液逐滴加入煮沸的蒸馏水中制备氢氧化铁胶体,正确的反应为:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+,故A错误;B.向FeBr2溶液中通入过量Cl2,亚铁离子和溴离子都完全反应,正确的离子方程式为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,故B错误;C.将NaHCO3溶液与过量的Ca(OH)2溶液混合,反应生成碳酸钙沉淀、氢氧化钠和水,反应的离子方程式为:HCO3-+OH-+Ca2+=CaCO3↓+H2O,故C正确;D.用KIO3氧化酸性溶液中的KI,反应生成碘单质和水,正确的离子方程式为:5I-+IO3-+6H+=3I2+3H2O,故D错误;故答案为C。
Fe(OH)3(胶体)+3H+,故A错误;B.向FeBr2溶液中通入过量Cl2,亚铁离子和溴离子都完全反应,正确的离子方程式为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,故B错误;C.将NaHCO3溶液与过量的Ca(OH)2溶液混合,反应生成碳酸钙沉淀、氢氧化钠和水,反应的离子方程式为:HCO3-+OH-+Ca2+=CaCO3↓+H2O,故C正确;D.用KIO3氧化酸性溶液中的KI,反应生成碘单质和水,正确的离子方程式为:5I-+IO3-+6H+=3I2+3H2O,故D错误;故答案为C。

【题目】以软锰矿(主要成分为MnO2)和硫锰矿(主要成分为MnS)为原料(已知两种原料中均不含有单质杂质)制备高纯度硫酸锰的工艺流程如图所示。
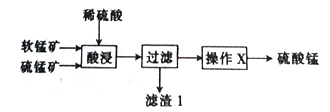
(1)已知滤渣1中含有一种非金属单质,该非金属单质的化学式为_____________________。
(2)已知二氧化锰与硫化锰的物质的量之比对酸浸时的浸出率有影响,相关实验数据如下表所示。当二氧化锰与硫化锰的物质的量之比为______________时,为最优反应配比。
号 | 二氧化锰与硫化锰的物质的量之比 | 浸出液的pH | 浸出率% |
1 | 1.25:1 | 2.5 | 95.30 |
2 | 1.75:1 | 2.5 | 97.11 |
3 | 2.25:1 | 2.5 | 99.00 |
4 | 2.5:1 | 2.5 | 98.40 |
(3)操作X为蒸发浓缩、______________、过滤,洗涤、烘干,在洗涤操作中,常用酒精洗涤MnSO4·H2O晶体,其主要目的是_________。
(4)现有10t锰矿,其中MnO2和MnS的含量均为29%,若流程中Mn的损耗率为10%,则最终制得硫酸锰(MnSO4·H2O)_________t。


