题目内容
16.铜和铝是日常生活和生产中重要金属,钛(Ti)有许多 的神奇功能,越来越引起人们的关注,依据三种金属的性质和用途,判断下列说法错误的是( )| A. | 钛和钛合金放在海水中数年,取出后仍光亮如初,这说明金属钛具有很强的抗腐蚀性 | |
| B. | 将大小厚薄相同的铜铝钛分别放入盛有相同稀盐酸的试管中,观察到盛钛的试管 放出气泡缓慢,盛铝的试管放出气泡快,盛铜试管无现象,由此可推测三种金属 活动性顺序为Al>Cu>Ti | |
| C. | 铜具有良好的导电性,可用来制造电线电缆 | |
| D. | 高层建设常采用铝合金门窗而不采用铁门窗,主要因为铝密度小易形成一层致密的氧化物薄膜 |
分析 A.Ti及其合金,与其结构及性质不活泼有关;
B.相同稀盐酸,金属活动性决定与酸的反应现象;
C.Cu为金属,含自由电子,可导电;
D.Al的密度比Fe的密度小.
解答 解:A.Ti及其合金,由其结构及性质不活泼可知,金属钛具有很强的抗腐蚀性,则放在海水中数年,取出后仍光亮如初,故A正确;
B.相同稀盐酸,金属活动性决定与酸的反应现象,由观察到盛钛的试管 放出气泡缓慢,盛铝的试管放出气泡快,盛铜试管无现象,由此可推测三种金属 活动性顺序为Al>Ti>Cu,故B错误;
C.Cu为金属,含自由电子,可导电,则铜具有良好的导电性,可用来制造电线电缆,故C正确;
D.Al的密度比Fe的密度小,且Al表面形成致密的氧化膜,高层建设常采用铝合金门窗而不采用铁门,故D正确;
故选B.
点评 本题考查金属及化合物的性质,为高频考点,把握物质的性质、性质与用途的关系等为解答的关键,侧重分析与应用能力的考查,注意选项D为易错点,题目难度不大.

练习册系列答案
相关题目
6.有Fe2+、NO${\;}_{3}^{-}$、Fe3+、NH${\;}_{4}^{+}$、H+和H2O六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是( )
| A. | 氧化剂和还原剂的物质的量之比为1:8 | |
| B. | 该过程说明Fe(NO3)2溶液不宜加酸酸化 | |
| C. | 每1molNO${\;}_{3}^{-}$发生还原反应,转移6mole- | |
| D. | 若把该反应设计为原电池,则负极反应为Fe2+-e-═Fe3+ |
7.下列离子方程式正确的是( )
| A. | 碳酸氢钠溶液与少量石灰水反应:HCO3-+OH-+Ca2+═H2O+CaCO3↓ | |
| B. | 氯化铵与氢氧化钠溶液混合:NH4++OH-═H2O+NH3↑ | |
| C. | 向漂白粉溶于水形成的溶液中通入少量的SO2:Ca2++3ClO-+SO2+H2O═CaSO4↓+Cl-+2HClO | |
| D. | 硫化亚铁溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ |
4.同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和O2,②NO2和O2,③NH3和N2.现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是( )
| A. | V1>V2>V3 | B. | V1>V3>V2 | C. | V3>V2>V1 | D. | V3>V1>V2 |
11.下列物质的转化在给定条件下能实现的是( )
| A. | S$\stackrel{O_{2}/点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | 饱和NaCl(aq)$\stackrel{NH_{3},CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| C. | Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3(aq)$\stackrel{△}{→}$无水FeCl3 | |
| D. | MgCl2(aq)$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{煅烧}{→}$MgO |
1.化合物A、B结构如图所示.下列关于两种有机化合物A、B的说法正确的是( )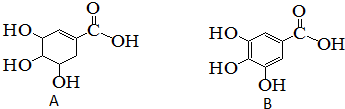
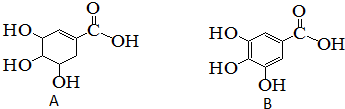
| A. | 化合物A和B遇三氯化铁溶液都显紫色 | |
| B. | 化合物A和B中所含官能团相同 | |
| C. | 等物质的量的A和B分别与足量的NaOH溶液反应,消耗NaOH的量相同 | |
| D. | 化合物A和B都能与溴水反应 |
8.下列发展中的化学电源中不属于充电电池的是( )
| A. | 铅蓄电池 | B. | 锂离子电池 | C. | 锌锰电池 | D. | 镍镉电池 |
5.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| C. | 1L0.1mol/L的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| D. | 235g核素${\;}_{92}^{235}$U发生裂变反应:${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$U+10${\;}_{0}^{1}$n净产生的中子(${\;}_{0}^{1}$n)数为10NA |