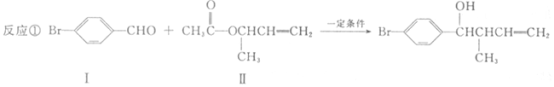题目内容
【题目】酸性干电池装置示意图如图,电池总反应为:Zn+2NH4+═Zn2++2NH3↑+H2↑,下列说法正确的是( )
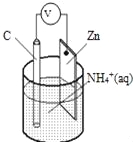
A.碳为电池的负极
B.氨气在碳棒上生成
C.电流由锌极流向碳极
D.H2在Zn片上生成
【答案】B
【解析】
试题分析:该装置是原电池,根据电池反应式知,放电时,Zn元素化合价由0价变为+2价、H元素化合价由+1价变为0价,所以Zn是负极、C是正极,负极反应式为Zn﹣2e﹣=Zn2+,正极反应式为2NH4++2e﹣=2NH3↑+H2↑,据此分析解答.
解:A.放电时,Zn元素化合价由0价变为+2价、H元素化合价由+1价变为0价,所以Zn是负极、C是正极,故A错误;
B.C是正极,正极上得电子发生还原反应,电极反应式为2NH4++2e﹣=2NH3↑+H2↑,所以氨气在碳棒上生成,故B正确;
C.电流从正极流向负极,即由碳棒流向锌极,故C错误;
D.C是正极,正极反应式为2NH4++2e﹣=2NH3↑+H2↑,所以H2在碳棒上生成,故D错误;
故选B.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目