题目内容
【题目】能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务.
(1)从能量的角度看,断开化学键要 (填“放出”或“吸收”)能量.已知拆开1molH﹣H键、1mol I﹣I、1mol H﹣I键分别需要吸收的能量为436kJ、151kJ、300kJ.则由H2和I2反应生成1mol HI需要 (填“放出”或“吸收”) kJ的热量.
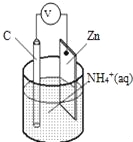
(2)某兴趣小组为研究原电池原理,设计如图1装置:
①a和b用导线连接,Zn发生 (填“氧化”或“还原”)反应.其电极反应式为 .溶液H+移向 (填“Cu”或“Zn”)极.
②无论a和b是否连接,Zn片均被腐蚀.若转移了0.4mol电子,则理论上Zn片质量减轻 g.
(3)①目前常用的镍(Ni)镉(Cd)电池其电池总反应式可以表示为:Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法中正确的是 (填序号).
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法中正确的是 (填序号).
a.以上反应是可逆反应
b.充电时化学能转变为电能
c.放电时化学能转变为电能
②图2为氢氧燃料电池的构造示意图,根据电子运动方向可知,则X极为电池的 (填“正”或“负”)极,Y极的电极反应方程式为 .

【答案】(1)吸收;放出; 6.5;
(2)①氧化; Zn﹣2e﹣=Zn2+; Cu;②13;
(3)①c;②负;O2+2H2O+4e﹣═4OH﹣.
【解析】
试题分析:(1)旧键断裂要吸收能量,新键生成要释放能量,当旧键断裂吸收的能量大于新键生成释放的能量时,反应为吸热反应,反之则为放热反应;
(2)①a和b用导线连接,该装置构成原电池,锌失电子发生氧化反应而作负极,铜作正极,正极上氢离子得电子发生还原反应,电解质溶液中阳离子向正极移动;
②根据锌与转移电子之间的关系式计算,Zn~Zn2+~2e﹣;
(3)①该电池放电时为原电池,充电时为电解池,根据反应条件是否相同判断是否为可逆反应;
②根据负极反应为2H2﹣4e﹣+4OH﹣=2H2O,则通入氢气的一极为负极,发生氧化反应,并可判断溶液呈碱性,碱性溶液中正极发生还原反应,电极反应为O2﹣4e﹣+2H2O=4OH﹣,据此分析.
解:(1)氢气和碘反应生成2molHI时,旧键断裂吸收能量的值为:436kJ+151kJ=587kJ,新键生成释放能量为:300kJ×2=600kJ,旧键断裂吸收的能量小于新键生成释放的能量,反应为放热反应,放出的热量为:600KJ﹣587kJ=13kJ,生成1molHI放热6.5kJ,
故答案为:吸收;放出; 6.5;
(2)①a和b用导线连接,该装置构成原电池,铜作正极,正极上氢离子得电子发生还原反应,锌失电子发生氧化反应而作负极,电极反应式为Zn﹣2e﹣=Zn2+,放电时,电解质溶液中氢离子向正极铜电极移动,
故答案为:氧化; Zn﹣2e﹣=Zn2+; Cu;
②根据锌和转移电子之间的关系式得,Zn~Zn2+~2e﹣,消耗锌的质量=![]() ×65g/mol=13g,
×65g/mol=13g,
故答案为:13;
(3)①a.因为电池冲放电在不同条件下进行,所以该电池反应不是可逆反应,故a错误;
b.该电池充电时,电能转变为化学能,故b错误;
c.该电池放电时,是将化学能转化为电能,故c正确;
故答案为:c;
②X极的电极反应式为2H2﹣4e﹣+4OH﹣=2H2O,则通入氢气的X极为负极,发生氧化反应,并可判断溶液呈碱性,碱性溶液中正极Y极发生还原反应,电极反应为O2﹣4e﹣+2H2O=4OH﹣,
故答案为:负;O2+2H2O+4e﹣═4OH﹣.

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案