题目内容
【题目】金属冶炼和处理常涉及氧化还原反应.
(1)由下列物质冶炼相应金属时采用电解法的是
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+2H2O,该反应的还原剂是 ,当1mol O2发生反应时,还原剂所失电子的物质的量为 mol.向CuSO4溶液中加入镁条时有气体生成,该气体是
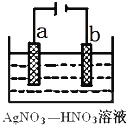
(3)下图为电解精炼银的示意图, (填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为
(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为 .
【答案】(1)bd;
(2)Cu2S;4;氢气;
(3)a;NO3﹣+e﹣+2H+=NO2↑+H2O;
(4)作电解质溶液,形成原电池.
【解析】
试题分析:(1)电解法:冶炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物(Al是电解熔融的三氧化二铝)制得;热还原法:冶炼较不活泼的金属Zn、Fe、Sn、Pb、Cu,常用还原剂有(C、CO、H2等);热分解法:Hg、Ag用加热分解氧化物的方法制得,物理分离法:Pt、Au用物理分离的方法制得;
(2)失电子化合价升高的反应物是还原剂,根据得失电子相等计算失去电子的物质的量,硫酸铜溶液呈酸性,镁和酸反应生成氢气;
(3)电解精炼银时,粗银作阳极,若b极有少量红棕色气体生成,则b电极上硝酸根离子得电子生成二氧化氮;
(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,该装置构成原电池,食盐水作电解质溶液,促进溶液的导电性.
解:(1)活泼金属采用电解法冶炼,钠、铝都是活泼金属,采用电解熔融态NaCl、Al2O3的方法冶炼,故选bd;
(2)在该反应中,Cu元素化合价由+1升高到+2,S元素由﹣2升高到+6,所以Cu2S做还原剂;
氧化还原反应中得失电子数相等,所以当有1molO2参与反应时失去4mol电子,则还原剂所失电子的物质的量为4mol;
硫酸铜是强酸弱碱盐,其溶液呈酸性,镁和酸反应生成氢气,
故答案为:Cu2S;4;氢气;
(3)电解精炼时,粗银做阳极,所以粗银是a极;
b电极是阴极,发生还原反应,生成了红棕色气体是NO2,电极反应:NO3﹣+e﹣+2H+=NO2↑+H2O,
故答案为:a;NO3﹣+e﹣+2H+=NO2↑+H2O;
(4)该装置构成原电池,氯化钠溶液作电解质溶液,促进溶液的导电能力,故答案为:作电解质溶液,形成原电池.

【题目】为探究影响化学反应速率的影响因素,将等质量的铁与过量盐酸反应,其他实验条件见下表。其中铁被反应完消耗时间最少的组别是
组别 | c(HCl)/ mol·L-1 | 温度/℃ | 铁的状态 |
A | 2.0 | 25 | 块状 |
B | 2.5 | 30 | 粉末状 |
C | 2.5 | 50 | 块状 |
D | 2.5 | 50 | 粉末状 |
A. A B. B C. C D. D