题目内容
【题目】已知常温下几种弱酸或弱碱的电离平衡常数(Ka或Kb)如下表所示:
酸或碱 | 电离平衡常数(Ka或Kb) |
CH3COOH | 1.8×10-5 |
HCN | 5×10-10 |
NH3H2O | 1.8×10-5 |
H2SO3 | K1=1.5×10-2,K2=1.1×10-7 |
回答下列问题:
(1)CH3COONH4的水溶液呈中性,其理由是_____________,溶液中各离子浓度大小的关系是___________________。
(2)等物质的量浓度的下列五种溶液:①NH3H2O ②(NH4)2SO3 ③NaHSO3 ④Na2SO3
⑤H2SO3溶液中水的电离程度由大到小的排列顺序为________(填序号)。
(3)向25 mL 0.10 molL-1盐酸中滴加氨水至过量,该过程中离子浓度大小关系可能正确的是________(填字母)。
A.c(Cl-)=c(NH4+)>c(H+)=c(OH-) B. c(NH4+)>c(Cl-)=c(H+)>c(OH-)
C.c(NH4+)>c(OH-)>c(Cl-)>c(H+) D.c(OH-)>c(NH4+)>c(H+)>c(Cl-)
(4)在室温下,0.05 molL-1的NaCN溶液的pH约为________。
【答案】NH4+、CH3COO-的水解程度相同 c(NH4+)=c(CH3COO-)>c(H+)=c(OH-) ②④③①⑤ AC 11
【解析】
(1)根据盐的水解规律分析;利用电荷守恒比较离子浓度大小;
(2)酸溶液和碱溶液抑制了水的电离,能够水解的盐溶液促进了水的电离,结合亚硫酸和一水合氨的电离平衡常数进行判断;
(3)根据电荷守恒、物料守恒、质子守恒,结合溶液的酸碱性判断溶液中离子浓度关系;
(4)室温下0.05mol/L NaCN溶液中存在水解平衡,CN-+H2O![]() HCN+OH-,Kh=
HCN+OH-,Kh=![]() 计算。
计算。
(1) CH3COONH4是弱酸弱碱盐,在水溶液中盐电离产生的NH4+、CH3COO-发生水解反应,NH4+水解消耗OH-,产生H+,使溶液显酸性;而CH3COO-发生水解反应消耗H+,产生OH-,根据醋酸、一水合氨的电离平衡常数相等,可知NH4+、CH3COO-水解程度相同,因此最终溶液中c(H+)=c(OH-),所以溶液呈中性,根据电荷守恒可知:c(NH4+)+c(H+)=c(OH-)+c(CH3COO-),由于溶液呈中性,c(H+)=c(OH-),所以c(NH4+)=c(CH3COO-),但水是弱电解质,其电离产生的H+、OH-浓度很小,远小于盐电离产生的离子浓度,因此该溶液中离子浓度大小关系c(NH4+)=c(CH3COO-)> c(H+)=c(OH-);
(2)等物质的量浓度的下列五种溶液:①NH3H2O;②(NH4)2SO3;③NaHSO3;④Na2SO3;⑤H2SO3,①和⑤都抑制了水的电离,其中⑤亚硫酸的电离平衡常数大于①氨水,则⑤中水的电离程度小于①;③中亚硫酸氢根离子的电离程度大于其水解程度,溶液显示弱酸性,抑制了水的电离;②中亚硫酸根离子、铵根离子促进了水的电离;④中亚硫酸根离子促进了水的电离,其中②中水的电离程度大于④,所以五种溶液水的电离程度由大到小的排列顺序为:②④③①⑤;
(3)A.根据电荷守恒,如溶液呈中性,c(H+)=c(OH-),则有c(Cl-)=c(NH4+),盐电离产生的离子浓度大于水电离产生的离子浓度,所以离子浓度可以符合关系:c(Cl-)=c(NH4+)>c(H+)=c(OH-),A正确;
B.若氨水稍稍过量时:c(NH4+)>c(Cl-)=c(OH-)>c(H+),若盐酸稍过量, c(Cl-)>c(NH4+)=c(H+)>c(OH-),B错误;
C.体系为NH4Cl溶液和NH3·H2O,氨水过量较多时,溶液呈碱性:c(NH4+)>c(OH-)>c(Cl-)>c(H+), C正确;
D.盐酸电离出的c(Cl-)=c(H+),氢离子被氨水中和一部分,所以c(H+)不可能大于c(Cl-),D错误;
故合理选项是AC;
(4)室温下0.05mol/L NaCN溶液中存在水解平衡,CN-+H2O![]() HCN+OH-,Kh=
HCN+OH-,Kh= ![]() =2×10-5;Kh=
=2×10-5;Kh=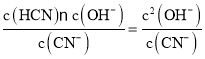 ,c2(OH-)=Khc(CN-)=2×10-5×0.05=10-6,所以c(OH-)=10-3mol/L,则溶液中c(H+)=10-11mol/L,因此溶液的pH=11。
,c2(OH-)=Khc(CN-)=2×10-5×0.05=10-6,所以c(OH-)=10-3mol/L,则溶液中c(H+)=10-11mol/L,因此溶液的pH=11。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】碳、氮、硫的化合物在生产生活中广泛存在。请回答:
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-l59.5 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) ΔH=-160.5 kJ·mol-1
③H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1
写出CO2与NH3合成尿素和气态水的热化学反应方程式____________。
(2)T1温度时在容积为2L的恒容密闭容器中只充入1.00molNO2气体发生反应:2NO(g)+O2(g)![]() 2NO2(g) H<0。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),
2NO2(g) H<0。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),
k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO2)如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
①从0~2s该反应的平均速率v(NO2)=___________。
②T1温度时化学平衡常数K=___________mol-1·L。
③化学平衡常数K与速率常数k正、k逆的数学关系是K=___________。若将容器的温度改变为T2时其k正=k逆,则T1__________T2 (填“>”、“<”或“=”)。
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是____________________(写出主要反应的离子方程式),该溶液中,c(Na+)______2c(SO32-)+c(HSO3-)(填“>”“<”或“=”)。
②在某NaHSO3、Na2SO3混合溶液中HSO3-、SO32-物质的量分数随pH变化曲线如图所示(部分),根据图示,则SO32-的第一步水解平衡常数=________。