题目内容
【题目】从某些性质看,NH3和H2O,NH4 +和H3O+,OH-和NH2-,N3—和O2—两两相似,据此判断下列反应式中不正确的是
A. 2Na+2NH3===2NaNH2+H2↑
B. 3CaO+4NH4Cl===Ca3N2+2NH3↑+3H2O+4HCl
C. 3Mg(NH2)2![]() Mg3N2+4NH3↑
Mg3N2+4NH3↑
D. NH4Cl+NaNH2===NaCl+2NH3↑
【答案】B
【解析】由题意知,NH3和H2O,NH4 +和H3O+,OH-和NH2-,N3—和O2—两两相似。类比2Na+2H2O===2NaOH+H2↑,可知2Na+2NH3===2NaNH2+H2↑可以发生;类比CaO+2HCl===CaCl2+2H2O,可知CaO+2 NH4Cl ===CaCl2+2H2O+2NH3↑可以发生、3CaO+4NH4Cl===Ca3N2+2NH3↑+3H2O+4HCl不可以发生;类比Mg(OH)2![]() MgO+H2O↑,可知3Mg(NH2)2
MgO+H2O↑,可知3Mg(NH2)2![]() Mg3N2+4NH3↑可以发生;类比HCl+NaOH===NaCl+H2O,可知NH4Cl+NaNH2===NaCl+2NH3↑可以发生。综上所述,B不正确,本题选B。
Mg3N2+4NH3↑可以发生;类比HCl+NaOH===NaCl+H2O,可知NH4Cl+NaNH2===NaCl+2NH3↑可以发生。综上所述,B不正确,本题选B。

【题目】氨广泛用于生产化肥、制冷剂等方面。回答下列问题:
(1)实验室可用下图所示装置合成氨。
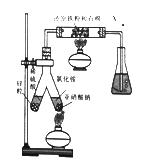
①合成氨时,还原铁粉的作用是________________。
②锥形瓶中盛有一定量的水,并滴有几滴酚酞试剂,反应—段时间后,锥形瓶中溶液变红,则气体X的成分为N2、水蒸气、____________和_________________。
⑵最近斯坦福大学研究人员发明了一种SUNCAT的锂循环系统,可持续合成氨,其原理如图所示。
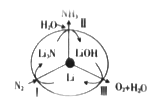
①图中反应Ⅱ的化学方程式为____________________。
②反应Ⅲ中能量转化的方式是__________________(填“电能转变为化学能”或“化学能转变为电能”)。
(3)液氨可用作制冷剂,液氨气化时__________(填“释放”或“吸收”)能量;液氨泄漏遇明火会发生爆炸。已知部分化学键的键能数据如下表所示:
共价键 | N-H | O=O | N≡N | O-H |
键能/kJ·mol-1 | 391 | 498 | 946 | 463 |
则反应 4NH3(g)+3O2(g)=2N2(g)+6H2O(g)的反应热△H=____________。
【题目】汽车尾气是城市空气的主要污染物,如何减少汽车尾气(CO、NOx等)的污染是重要的科学研究课题。
(1)一定条件下的密闭容器中,进行反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),下列说法不能说明该反应达到平衡的是____(填字母)。
N2(g)+2CO2(g),下列说法不能说明该反应达到平衡的是____(填字母)。
A.NO的生成速率与NO的消耗速率相等 B.υ(CO)=υ(CO2)
C.体系的压强保持不变 D.各物质的浓度保持不变
(2)可用活性炭还原法处理氮氧化物。有关反应的化学方程式为:C(s)+2NO(g)![]() N2(g)+CO2(g)△H>0某研究小组向密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)△H>0某研究小组向密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol·L﹣1 时间/min | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
①写出该反应的平衡常数表达式:K=____________________。
②30min后,改变某一条件,平衡发生了移动,则改变的条件是_______________;若升高温度,NO浓度将_______(填“增大”、“不变”或“减小”)。
③计算从0~20min内,NO的平均反应速率为___________________。
(3)在一定温度和压强下,CO和H2催化合成二甲醚的反应为:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g),若一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。则:反应开始时正、逆反应速率的大小:υ(正)____υ(逆)(填“ >”、“ < ”或“=”)。
CH3OCH3(g)+CO2(g),若一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。则:反应开始时正、逆反应速率的大小:υ(正)____υ(逆)(填“ >”、“ < ”或“=”)。
