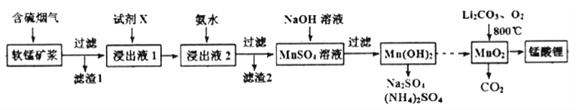
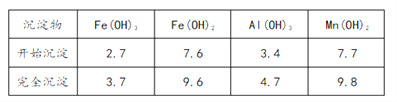
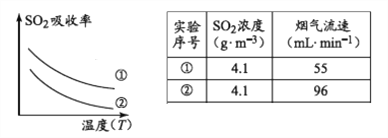
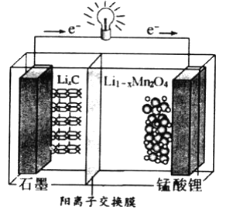
��Ŀ����
����Ŀ���������Ƿ��Ϳɵ����ᣬΪ�о�����ķ�����ɺͽṹ������������ʵ�飺
��1����ȡ����0.90g����ij��״����ʹ����ȫ��������ͬ״����ͬ�����H2������Ϊ0.02g�����������Է�������Ϊ ��
��2��������������������������ȼ��ֻ����CO2��H2O��g������ȫ������ʯ������ʱ����ʯ�ҵ���������1.86g�������˲���ͨ�����ʯ��ˮ�У������3.00g��ɫ������������ķ���ʽΪ ��
��3����ȡ0.90g���ᣬ�������������Ʒ�Ӧ������H2224mL����״��������������̼�����Ʒ�Ӧ������224mLCO2����״������������Ľṹ��ʽ����Ϊ�� ��
��4���������Ƿ���ֻ�������ᣬ�䷴Ӧ�Ļ�ѧ����ʽΪ ��
��5�����������ᡢ�������Ҵ����ܷ���������Ӧ����ͬ�������������ɵ�������������л����������Ϊ ��
���𰸡�
��1��90
��2��C3H6O3
��3��CH2��OH��CH2COOH��![]()
��4��C6H12O6 ![]() 2CH3CH��OH��COOH
2CH3CH��OH��COOH
��5��66��59
���������⣺��1����Է�������֮�ȵ����ܶ�֮�ȣ���Mr�����ᣩ��2=0.9g��0.02g����Mr�����ᣩ=90���ʴ�Ϊ��90����2��3.00g��ɫ����Ϊ̼��ƣ����ʵ���Ϊ ![]() =0.03mol����������ʵ���Ϊ
=0.03mol����������ʵ���Ϊ ![]() =0.01mol��0.01mol������ȫȼ������CO2 0.03 mol�������������Cԭ����ĿΪ
=0.01mol��0.01mol������ȫȼ������CO2 0.03 mol�������������Cԭ����ĿΪ ![]() =3������H2O������=1.86g��0.03mol��44g/mol=0.54g�������ʵ���Ϊ0.03 mol�����������Hԭ����ĿΪ
=3������H2O������=1.86g��0.03mol��44g/mol=0.54g�������ʵ���Ϊ0.03 mol�����������Hԭ����ĿΪ ![]() =6�������������Oԭ����ĿΪ
=6�������������Oԭ����ĿΪ ![]() =3����������ķ���ʽΪC3H6O3 ��
=3����������ķ���ʽΪC3H6O3 ��
�ʴ�Ϊ��C3H6O3����3����������ʵ���Ϊ ![]() =0.01mol����̼���Ʒ�Ӧ���ɶ�����̼Ϊ
=0.01mol����̼���Ʒ�Ӧ���ɶ�����̼Ϊ ![]() =0.005mol������2��COOH��CO2������������Ӻ���1����COOH�����Ʒ�Ӧ��������Ϊ
=0.005mol������2��COOH��CO2������������Ӻ���1����COOH�����Ʒ�Ӧ��������Ϊ ![]() =0.01mol��2��COOH��H2����2��OH��H2������֪������ӻ�����һ����OH����֪����Ľṹ��ʽ������CH2��OH��CH2COOH��
=0.01mol��2��COOH��H2����2��OH��H2������֪������ӻ�����һ����OH����֪����Ľṹ��ʽ������CH2��OH��CH2COOH�� ![]() ��
��
�ʴ�Ϊ��CH2��OH��CH2COOH�� ![]() ����4���������Ƿ���ֻ�������ᣬ�䷴Ӧ�Ļ�ѧ����ʽΪ��C6H12O6
����4���������Ƿ���ֻ�������ᣬ�䷴Ӧ�Ļ�ѧ����ʽΪ��C6H12O6 ![]() 2CH3CH��OH��COOH��C6H12O6 �������ǣ���
2CH3CH��OH��COOH��C6H12O6 �������ǣ���
�ʴ�Ϊ��C6H12O6 ![]() 2CH3CH��OH��COOH����5���������������ɵ�������Է�������Ϊ60+90��18=132���������Ҵ����ɵ�������Է�������Ϊ46+90��18=118����ͬ�������������ɵ�������������л����������Ϊ��132��118=66��59��
2CH3CH��OH��COOH����5���������������ɵ�������Է�������Ϊ60+90��18=132���������Ҵ����ɵ�������Է�������Ϊ46+90��18=118����ͬ�������������ɵ�������������л����������Ϊ��132��118=66��59��
�ʴ�Ϊ��66��59��
��1����Է�������֮�ȵ������ܶ�֮�ȣ���2��3.00g��ɫ����Ϊ̼��ƣ���ʯ������Ϊ�������ɶ�����̼��ˮ�������������������̼����������ʵ�������������ȼ������ˮ������������ԭ���غ���������C��Hԭ����Ŀ���ٸ�����Է�����������Oԭ����Ŀ������ȷ������ʽ����3������Ϊ0.01mol����̼���Ʒ�Ӧ���ɶ�����̼Ϊ0.005mol������̼��˵��������Ӻ���1����COOH�����Ʒ�Ӧ����0.01mol��������˵��������һ����OH����Ϸ���ʽ��д���ܵĽṹ��ʽ����4����ϣ�3��������Ŀ��ܽṹ��д����ʽ����5����ͬ�������������ɵ�������������л���������ȵ������ֲ����Ħ������֮�ȣ�