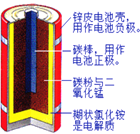
题目内容
【题目】将0.1mol MnO2加到10mL过氧化氢(H2O2)的水溶液里(密度为1.1g/mL),在标准状况下放出气体的体积和时间的关系如图:
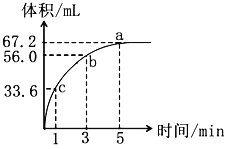
(1)a、b、c三点反应速率快慢顺序为_______,反应速率变化的可能原因是______________。
(2)计算过氧化氢的起始物质的量浓度是多少?_______________
(3)假设反应过程中溶液的体积保持不变,则用H2O2表示该反应1—3分钟内的平均速率为多少?_________________
【答案】a < b < c 随着反应的进行双氧水浓度越来越小 0.6mol/L 0.1mol/(L·min)
【解析】
(1)从影响化学反应速率的因素随着反应的进行双氧水浓度越来越小。
(2)根据c=n÷V计算;
(3)根据v=△c÷△t计算;
(1)a、b、c三点反应速率快慢顺序为a < b < c,反应速率变化的可能原因是随着反应的进行双氧水浓度越来越小。
故答案为:a < b < c,随着反应的进行双氧水浓度越来越小。
(2)由图可知双氧水分解后得到67.2mLO2,根据方程式:2H2O2=2H2O+O2↑,c(H2O2)=2×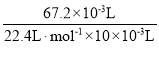 =0.6mol·L-1,即过氧化氢的起始物质的量浓度是0.6mol·L-1,故答案为:0.6mol·L-1;
=0.6mol·L-1,即过氧化氢的起始物质的量浓度是0.6mol·L-1,故答案为:0.6mol·L-1;
(3)假设反应过程中溶液的体积保持不变,则用H2O2表示该反应1—3分钟内的平均速率为:v=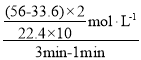 =0.1mol/(L·min),故答案为:0.1mol/(L·min)。
=0.1mol/(L·min),故答案为:0.1mol/(L·min)。

 名校课堂系列答案
名校课堂系列答案【题目】化学小组探究铜与硝酸反应的快慢及产物。
(1)实验甲:将铜片放入盛有稀HNO3的试管中,开始无明显现象,后逐渐有小气泡生成,该气体是______。在液面上方出现浅红棕色气体,溶液呈蓝色。
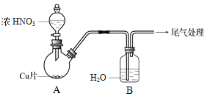
(2)实验乙:铜与浓HNO3反应,装置、现象如下:
实验装置 | 实验现象 |
| A中:最初反应较慢,随后加快,反应剧烈;产生红棕色气体;溶液呈绿色。 B中:溶液呈淡蓝色。 |
①A中铜与浓HNO3产生红棕色气体的化学方程式是 ______。
②实验现象“最初反应较慢,随后加快”的原因可能是 ______。
(3)有文献记载:铜与浓HNO3反应一旦发生就变快,是因为开始生成的NO2溶于水形成HNO2(弱酸,不稳定),它再和Cu反应,反应就加快。实验探究如下:
I:向 1 mL浓硝酸中加入几滴30% H2O2溶液、铜片,反应较慢,溶液呈蓝色。
II:向1 mL浓硝酸中加入几滴30% H2O2溶液,无明显变化。
①I中反应变慢的原因是 ______。
②NO2与H2O反应生成HNO2和 ______。
③对生成HNO2后反应变快的原因进行实验探究。
序号 | 实验操作 | 实验现象 |
III | 取B中溶液,加入一定量固体,再加入铜片 | 立即产生无色气体;液面上方呈红棕色 |
IV | 取B中溶液,放置一段时间,溶液变为无色后,再加入铜片 | 产生无色气体,较Ⅲ慢;液面上方呈浅红棕色 |
a.III中加入的固体为______。
b.IV中“放置一段时间”的目的是 ______。
实验III、IV可以说明,HNO2氧化Cu的反应速率比HNO3氧化Cu的反应快。
(4)化学小组同学结合实验甲、乙中HNO3被还原后的气体产物以及实验III的产物,综合上述实验,分析判断甲中反应慢的原因,除了硝酸起始浓度小、反应过程中温度较低外,另一个重要原因是 ______。