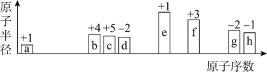
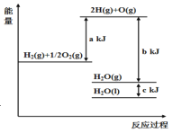
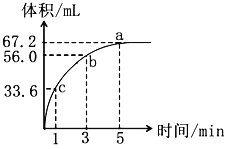
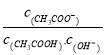题目内容
【题目】化学电池在通迅、交通及日常生活中有着广泛的应用。
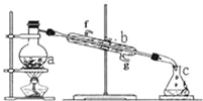
(1)如图是锌锰干电池的基本构造图。
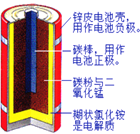
①该干电池工作时负极上的电极反应式是_______________MnO2的作用是除去正极上的产物H2,本身生成Mn2O3,该反应的化学方程式是______________。
②关于该电池的使用和性能,说法正确的是 (______)
A.该电池可充电后反复使用
B.该电池可用于闹钟、收音机、照相机等
C.该电池使用后能投入火中,也可投入池塘中
D.外电路中每通过0.2mol电子,负极的质量理论上减小6.5g
(2)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可表示为: Cd +2NiO(OH)+2H2O 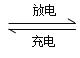 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难于溶水但能溶于酸,以下说法正确的是 (______)
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难于溶水但能溶于酸,以下说法正确的是 (______)
A .以上反应是可逆反应 B.以上反应不是可逆反应
C. 电池放电时Cd 做负极 D. 电池放电时Cd 做正极
(3)废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍镉电池可以使一平方米的耕地失去使用价值。在酸性土壤中这种污染更为严重这是因为___________。
(4)另一种常用的电池锂电池由于比容量(单位质量电极材料所能转换的电量)特别大而广泛用于心脏起搏器,一般使用时间可长达十年,它的负极材料用金属锂制成,电解质溶液需用非水溶液配制,请用化学方程式表示不能用水溶液的原因___________。
【答案】Zn-2e-=Zn2+ 2MnO2+H2=Mn2O3+H2O BD BC 金属镍镉都可与酸反应生成重金属离子 2Li +2H2O =2LiOH + H2↑
【解析】
(1)①锌锰干电池中负极材料是锌,电极反应式为Zn-2e-=Zn2+;正极上发生还原反应;
②A.干电池属于一次电池;
B.该电池可用于闹钟、收音机、照相机等;
C.该电池会污染环境;
D.外电路中每通过0.2mol电子,消耗的Zn的物质的量为0.1mol,所以锌的质量理论上减小6.5g;
(2)放电时Cd失电子,作负极,发生氧化反应,NiO(OH)得电子作正极,发生还原反应,据此判断;
(3)金属镍镉都可与酸反应生成重金属离子,污染土壤和水等环境;
(4)锂是活泼金属,极易与水反应。
(1)①锌锰干电池中,锌易失电子发生氧化反应而作负极,所以负极材料是Zn,负极上电极反应式为Zn-2e-=Zn2+,MnO2的作用是除去正极上的产物H2,本身生成Mn2O3,该反应的化学方程式是2MnO2+H2=Mn2O3+H2O
故答案为:Zn-2e-=Zn2+;2MnO2+H2=Mn2O3+H2O;
②A.该电池属于一次电池,不能反复使用,故A错误;
B.该电池中产生的电能较少,所以可用于闹钟、收音机、照相机等,故B正确;
C.该电池中含有酸性物质、锰等金属,会污染地下水和土壤,所以不能焚烧、埋入土壤,故C错误;
D.负极反应式为Zn-2e-=Zn2+,外电路中每通过0.2mol电子,锌的质量理论上减小质量=
![]() =6.5g,故D正确;
=6.5g,故D正确;
故答案为:BD;
(2)放电时,负极上Cd失电子发生了氧化反应,反应为Cd+2OH--2e-═Cd(OH)2,NiO(OH)得电子作正极,发生还原反应,反应式为:NiOOH(s)+H2O+e-=Ni(OH)2(s)+OH-,
A .以上反应的反应条件不同,不是可逆反应,故A错误;
B.由A分析可知,以上反应不是可逆反应,故B正确;
C. 电池放电时Cd做负极,失电子发生了氧化反应,故C正确;
D. 由C可知电池放电时Cd做负极,故D错误;
故选BC。
(3)金属镍和镉都是较活泼的金属,都可与酸反应生成重金属离子,污染土壤和水等环境;故答案为:金属镍镉都可与酸反应生成重金属离子;
(4)锂是活泼金属,极易与水反应,用化学方程式表示不能用水溶液的原因:2Li +2H2O =2LiOH + H2↑。故答案为:2Li +2H2O =2LiOH + H2↑。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案