题目内容
【题目】C、N、S和Cl元素的单质及化合物在工业生产中的有效利用备受关注。请回答下列问题:
(1)已知:I.2SO2(g)+O2(g)+2H2O(1) =2H2SO4(aq) △H1;
Ⅱ.Cl2(g)+H2O(1)![]() HCl(aq)+HClO(aq) △H2;
HCl(aq)+HClO(aq) △H2;
Ⅲ.2HClO(aq) =2HCl(aq)+O2(g) △H3
SO2(g)+Cl2(g)+2H2O(1)=2HCl(aq)+H2SO4 (aq) △H4=__________(用含有△H1、△H2和△H3的代数式表示)。
(2)25℃时,H2SO3溶液中各含硫微粒的物质的量分数(δ)与溶液pH的变化关系如图所示。

已知25℃时,NaHSO3的水溶液pH<7,用图中的数据通过计算解释原因 ____________________。
(3)利用“ Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“ Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:

①放电时,正极的电极反应式为______。
②选用高氯酸钠—四甘醇二甲醚做电解液的优点是_______(至少写两点)。
(4)氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHC12和NC13),副产物少于其它水消毒剂。
①一氯胺(NH2Cl)的电子式为_______。一氯胺是重要的水消毒剂,其原因是由于一氯胺在中性、酸性环境中会发生水解,生成具有强烈杀菌作用的物质,该反应的化学方程式为_______。
②在恒温条件下,2molCl2和1molNH3发生反应2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g),测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:
NHCl2(l)+2HCl(g),测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:

计算C点时该反应的压强平衡常数Kp(C)= _______ (Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
【答案】(△H1+2△H2+△H3)/2 由图中数据可以计算出Ka2(H2SO3)=10-7.2 ,Ka1(H2SO3)=10-1.9,所以HSO3—的水解常数是10-12.1,HSO3—电离程度大于水解程度,溶液显酸性 3CO2+4Na++4e-═2Na2CO3+C 导电性好、与金属钠不反应、难挥发等特点 ![]() NH2Cl+H2O═NH3+HClO 0.5MPa-1
NH2Cl+H2O═NH3+HClO 0.5MPa-1
【解析】
(1)根据盖斯定律,反应SO2(g)+Cl2(g)+2H2O(l)=2HCl(aq)+H2SO4(aq)是(Ⅰ+2×Ⅱ+Ⅲ)/2,那么△H4=(△H1+2△H2+△H3)/2;
(2)由图中数据可以,求出H2SO3的Ka1和Ka2,![]() ;
;
同理,用pH=7.2的数据计算,可以得到Ka2=10-7.2,HSO3-既可以水解又可以电离,电离常数为Ka2,水解常数Kh=Kw/Ka1=10-14/10-1.9=10-12.1,水解大于电离,溶液呈酸性;
(3)根据总反应方程式,正极是CO2得电子变成C,电极反应式为3CO2+4Na++4e-═2Na2CO3+C;不选择水做溶剂,而选择有机物做溶剂,可以知道Na不和有机物发生反应,此外可以根据,电解质溶液的作用来答题,应该要有导电性好,难挥发等等;
(4)①可以按照氨气的电子式来写,一氯氨可以当做氯代替氨气中的一个H。电子式为![]() ;根据水解反应的特点,要和水发生作用,一部分结合氢氧根,一部分结合氢离子,产生一种具有强烈杀菌的作用,应该是次氯酸,可以写出来NH2Cl+H2O═NH3+HClO;②C点平衡时Cl2和HCl的物质的量浓度相等,可以利用三段式列出式子,设转化NH3物质的量为x
;根据水解反应的特点,要和水发生作用,一部分结合氢氧根,一部分结合氢离子,产生一种具有强烈杀菌的作用,应该是次氯酸,可以写出来NH2Cl+H2O═NH3+HClO;②C点平衡时Cl2和HCl的物质的量浓度相等,可以利用三段式列出式子,设转化NH3物质的量为x
2Cl2(g) + NH3 (g) ![]() NHCl2(l) + 2HCl(g)
NHCl2(l) + 2HCl(g)
开始(mol) 2 1 0 0
转换(mol) 2x x 2x
C点的平衡(mol) 2-2x 1-x 2x
则2-2x=2x,解得x=0.5mol,平衡时Cl2、NH3、HCl物质的量依次为1mol、0.5mol、1mol,NHCl2为液体,计算压强是不计入,气体一共2.5mol,总压为10MPa,可以Cl2、NH3、HCl分压为4MPa、2MPa、4MPa;![]() 。
。
(1)根据盖斯定律,反应SO2(g)+Cl2(g)+2H2O(l)=2HCl(aq)+H2SO4(aq)是(Ⅰ+2×Ⅱ+Ⅲ)/2,那么△H4=(△H1+2△H2+△H3)/2;
(2) 由图中数据可以,求出H2SO3的Ka1和Ka2,![]() ;
;
同理,用pH=7.2的数据计算,可以得到Ka2=10-7.2,水解常数Kh=Kw/Ka1=10-14/10-1.9=10-12.1,水解大于电离,溶液呈酸性;
(3)根据总反应方程式,正极是CO2得电子变成C,电极反应式为3CO2+4Na++4e-═2Na2CO3+C;不选择水做溶剂,而选择有机物做溶剂,可以知道Na不和有机物发生反应,此外可以根据,电解质溶液的作用来答题,应该要有导电性好,难挥发等等;
(4)①可以按照氨气的电子式来写,一氯氨可以当做氯代替氨气中的一个H。电子式为![]() ;根据水解反应的特点,要和水发生作用,一部分结合氢氧根,一部分结合氢离子,产生一种具有强烈杀菌的作用,应该是次氯酸,可以写出来NH2Cl+H2O═NH3+HClO;②C点平衡时Cl2和HCl的物质的量浓度相等,可以利用三段式列出式子,设转化NH3物质的量为x
;根据水解反应的特点,要和水发生作用,一部分结合氢氧根,一部分结合氢离子,产生一种具有强烈杀菌的作用,应该是次氯酸,可以写出来NH2Cl+H2O═NH3+HClO;②C点平衡时Cl2和HCl的物质的量浓度相等,可以利用三段式列出式子,设转化NH3物质的量为x
2Cl2(g) + NH3 (g) ![]() NHCl2(l) + 2HCl(g)
NHCl2(l) + 2HCl(g)
开始(mol) 2 1 0 0
转换(mol) 2x x 2x
C点的平衡(mol) 2-2x 1-x 2x
则2-2x=2x,解得x=0.5mol,平衡时Cl2、NH3、HCl物质的量依次为1mol、0.5mol、1mol,NHCl2为液体,计算压强是不计入,气体一共2.5mol,总压为10MPa,可以Cl2、NH3、HCl分压为4MPa、2MPa、4MPa;![]() 。
。

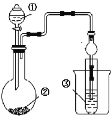
【题目】用如图所示装置(夹持已装置省略)进行下列实验,能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A | 稀硫酸 | Na2S | AgNO3与AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) | |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀硫酸 | Na2CO3 | CaCl2溶液 | CO2可与氯化钙反应 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. AB. BC. CD. D