题目内容
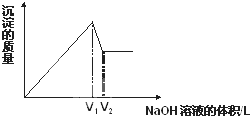 向aL一定浓度的MgCl2和AlCl3混合溶液中,逐滴加入c mol/L的NaOH溶液,生成沉淀的质量与滴入NaOH溶液体积的关系如图所示.则混合溶液中c(Mg2+)/c(Al3+)的比值为( )
向aL一定浓度的MgCl2和AlCl3混合溶液中,逐滴加入c mol/L的NaOH溶液,生成沉淀的质量与滴入NaOH溶液体积的关系如图所示.则混合溶液中c(Mg2+)/c(Al3+)的比值为( )分析:根据图象知,当镁离子和铝离子完全转化为沉淀时,发生的化学反应为:2NaOH+MgCl2=2NaCl+Mg(OH)2↓、3NaOH+AlCl3=3NaCl+Al(OH)3↓,所以V1为生成Mg(OH)2和Al(OH)3需要的NaOH的体积,
当沉淀最大时,继续滴加NaOH溶液,发生反应NaOH+Al(OH)3=NaAlO2+2H2O,当沉淀完全溶解时消耗的NaOH的体积=(V2-V1)L,根据3NaOH+AlCl3=3NaCl+Al(OH)3↓和NaOH+Al(OH)3=NaAlO2+2H2O
知,铝元素完全转化为沉淀和沉淀完全溶解消耗NaOH的体积之比为3:1,V1减去与氯化铝反应的NaOH体积就是与氯化镁反应的NaOH体积,再根据NaOH和氯化镁之间的关系式计算镁离子浓度.
当沉淀最大时,继续滴加NaOH溶液,发生反应NaOH+Al(OH)3=NaAlO2+2H2O,当沉淀完全溶解时消耗的NaOH的体积=(V2-V1)L,根据3NaOH+AlCl3=3NaCl+Al(OH)3↓和NaOH+Al(OH)3=NaAlO2+2H2O
知,铝元素完全转化为沉淀和沉淀完全溶解消耗NaOH的体积之比为3:1,V1减去与氯化铝反应的NaOH体积就是与氯化镁反应的NaOH体积,再根据NaOH和氯化镁之间的关系式计算镁离子浓度.
解答:解:根据图象知,当镁离子和铝离子完全转化为沉淀时,发生的化学反应为:2NaOH+MgCl2=2NaCl+Mg(OH)2↓、3NaOH+AlCl3=3NaCl+Al(OH)3↓,所以V1为生成Mg(OH)2和Al(OH)3需要的NaOH的体积,
当沉淀最大时,继续滴加氢氧化钠溶液,发生反应NaOH+Al(OH)3=NaAlO2+2H2O,当沉淀完全溶解时消耗的氢氧化钠的体积=(V2-V1)L,根据NaOH+Al(OH)3=NaAlO2+2H2O中氢氧化钠和铝原子的关系式知,
c(Al3+)×aL=(V2-V1)L×c mol/L,所以c(Al3+)=
mol/L;
根据3NaOH+AlCl3=3NaCl+Al(OH)3↓和NaOH+Al(OH)3=NaAlO2+2H2O知,铝元素完全转化为沉淀和沉淀完全溶解消耗氢氧化钠的体积之比为3:1,则铝离子完全沉淀时需要氢氧化钠的体积=3(V2-V1)L,与镁离子反应的氢氧化钠体积=V1-3(V2-V1)L=(4V1-3V2)L,
根据2NaOH+MgCl2=2NaCl+Mg(OH)2↓知,2c(Mg2+)×aL=(4V1-3V2)L×c mol/L,c(Mg2+)=
mol/L,
所以c(Mg2+)/c(Al3+)=
mol/L:
mol/L=
,
故选A.
当沉淀最大时,继续滴加氢氧化钠溶液,发生反应NaOH+Al(OH)3=NaAlO2+2H2O,当沉淀完全溶解时消耗的氢氧化钠的体积=(V2-V1)L,根据NaOH+Al(OH)3=NaAlO2+2H2O中氢氧化钠和铝原子的关系式知,
c(Al3+)×aL=(V2-V1)L×c mol/L,所以c(Al3+)=
| (V2-V1)c |
| a |
根据3NaOH+AlCl3=3NaCl+Al(OH)3↓和NaOH+Al(OH)3=NaAlO2+2H2O知,铝元素完全转化为沉淀和沉淀完全溶解消耗氢氧化钠的体积之比为3:1,则铝离子完全沉淀时需要氢氧化钠的体积=3(V2-V1)L,与镁离子反应的氢氧化钠体积=V1-3(V2-V1)L=(4V1-3V2)L,
根据2NaOH+MgCl2=2NaCl+Mg(OH)2↓知,2c(Mg2+)×aL=(4V1-3V2)L×c mol/L,c(Mg2+)=
| (4V1-3V2)c |
| 2a |
所以c(Mg2+)/c(Al3+)=
| (4V1-3V2)c |
| 2a |
| (V2-V1)c |
| a |
| 4V1-3V2 |
| 2(V2-V1) |
故选A.
点评:本题以镁铝化合物为载体考查了混合物的计算,知道曲线拐点及变化趋势的含义是解本题关键,再结合方程式来分析解答,注意铝离子完全转化为沉淀和沉淀完全溶解需要氢氧化钠物质的量的关系,为易错点,题目难度中等.

练习册系列答案
相关题目
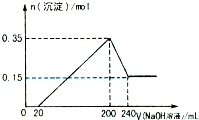 将一定质量的Mg、Al合金投入2.0mol/L、250mL的稀硫酸中,金属全部溶解.然后向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )
将一定质量的Mg、Al合金投入2.0mol/L、250mL的稀硫酸中,金属全部溶解.然后向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )| A、当加入NaOH溶液的体积为20 mL时,溶液的pH等于7 | B、当加入NaOH溶液的体积为20 mL时,溶液中的溶质只有硫酸镁和硫酸铝 | C、生成的H2在标准状况下的体积为11.2 L | D、所加NaOH溶液的物质的量浓度为5.0 mol/L |
 将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:
将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求: 将一定质量的Mg和Al的混合物投入250mL、2.0mol/L稀硫酸中,固体全部溶解并产生气体0待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )
将一定质量的Mg和Al的混合物投入250mL、2.0mol/L稀硫酸中,固体全部溶解并产生气体0待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )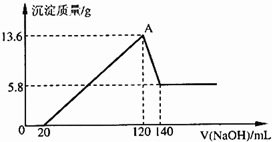
 将一定质量的Mg和Al混合物投入500mL 稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )
将一定质量的Mg和Al混合物投入500mL 稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )