题目内容
实验室用二氧化锰和浓盐酸反应制取氯气。
(1)若用200mL10mol·L-1的浓盐酸与足量的二氧化锰固体加热反应(不考虑氯化挥发),则产生氯气的物质的量为 0.56mol(填“大于”、“等于”或“小于”),原因是 。
(2)870g二氧化锰与足量的浓盐酸反应,则被氧化的氯化氢的物质的量是多少?
【答案】
(1)小于 随着反应的进行,盐酸的浓度逐渐减小,稀盐酸与二氧化锰不再反应,故应小于0.5mol (2)20mL
【解析】
试题分析:(1)由于二氧化锰在和浓盐酸的反应过程中,盐酸的浓度会逐渐降低。而稀盐酸不能被氧化生成氯气,所以产生氯气的物质的量小于0.56mol。
(2)870g二氧化锰的物质的量是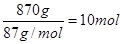 ,锰元素的化合价从+4价降低到+2价,得到2个电子,所以10mol二氧化锰得到的电子是20mol。氯元素的化合价从-1价升高到0价,失去1个电子,所以根据电子的得失守恒可知,被氧化的氯化氢的物质的量是20mol。
,锰元素的化合价从+4价降低到+2价,得到2个电子,所以10mol二氧化锰得到的电子是20mol。氯元素的化合价从-1价升高到0价,失去1个电子,所以根据电子的得失守恒可知,被氧化的氯化氢的物质的量是20mol。
考点:考查氯化氢的实验制备的有关判断和计算
点评:本题属于基础性试题的考查,难度不大。主要是培养学生尊重客观事实的学习态度,以及如何利用电子的得失守恒进行的有关计算。本题有利于激发学生学习化学的兴趣。

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
A、实验室用二氧化锰和浓盐酸制取氯气:MnO2+4HCl
| ||||
B、铜与稀硝酸反应:Cu+4H++2N
| ||||
C、向氯化铝溶液中通入过量氨气:A13++4OH-?A1
| ||||
D、向Ca(OH)2溶液中加入过量NaHCO3溶液:Ca2++2HC
|
实验室常用强氧化剂(如KMnO4、KClO3、MnO2等)氧化浓盐酸的方法来制备氯气.某研究性学习小组欲探究用Na2O2与浓盐酸制备并检验氯气.供选用的实验试剂及装置如下(部分导管、蒸馏水略):
a、Na2O2 b、浓盐酸 c、碱石灰 d、NaOH溶液 e、淀粉-KI溶液
f、CaCO3g、石蕊试液 h、饱和NaCl溶液
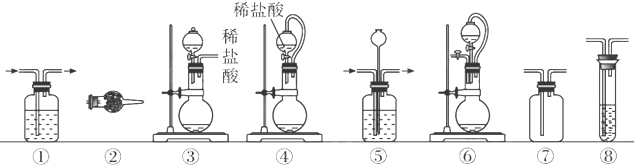
(1)写出实验室用二氧化锰和浓盐酸反应制备氯气的离子方程式
(2)写出用Na2O2与浓盐酸制备氯气的化学方程式 .该反应中盐酸的作用是
(3)下列装置组合最合理的是 (填序号,需考虑实验结束撤除装置时残留有害气体的处理).
(4)尾气经处理后仍有较多气体排出,其主要原因可用化学方程式表示为: .
(5)某小组成员建议用双氧水代替过氧化钠进行实验更好,请你给出两条合适的理由:
① ,
② .
a、Na2O2 b、浓盐酸 c、碱石灰 d、NaOH溶液 e、淀粉-KI溶液
f、CaCO3g、石蕊试液 h、饱和NaCl溶液

(1)写出实验室用二氧化锰和浓盐酸反应制备氯气的离子方程式
(2)写出用Na2O2与浓盐酸制备氯气的化学方程式
(3)下列装置组合最合理的是
| 组合 | 制备装置 | 净化装置 | 检验装置/试剂 | 尾气处理装置 |
| A | ③ | ② | ⑦/e | ⑤ |
| B | ③⑥ | ① | ⑧/g | ① |
| C | ④ | ① | ⑤/e | ② |
| D | ⑥ | ⑤ | ⑧/g | ① |
(5)某小组成员建议用双氧水代替过氧化钠进行实验更好,请你给出两条合适的理由:
①
②
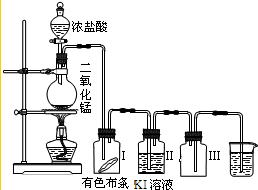 某同学实验室用下列装置探究氯气的性质.
某同学实验室用下列装置探究氯气的性质.