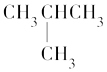��Ŀ����
����Ŀ�������������ʵ���Ҫ���Ԫ��֮һ���������������������������أ�
��1����ԭ�����������Ų�ʽΪ���������ӣ�N3�������������˶�״̬��ͬ�ĵ��ӣ�N4���ӵĿռ�ṹ��ͼ�� ![]() ������һ�����ӣ�������ԡ��Ǽ��ԡ���
������һ�����ӣ�������ԡ��Ǽ��ԡ���
��2���������˹��̵��IJ������������ˮ��1��700��������NH3H2O�������ʵ��֤��NH3H2O������ ��
��3����100mL 0.1mol/L��������ͨ��0.02mol������������պ�����Һ�ʼ��ԣ������Һ��NH3H2O��NH4+��Cl�������������ʵ���Ũ�ȴ�С��ϵΪ ��
��4����ο��������ʣ�ʵ���Ҽ�������е�NH4+ʱ����ȡ���������Ʒ���Թ��У�����ǿ��Ũ��Һ�����ȣ���������������ʹ �� ˵����NH4+ ��
��5��NaN3����������������ȫ���ң�����������ײ��ʱ��NaN3��Ѹ�ٷֽ����Na��N2 �� ��д���÷�Ӧ�Ļ�ѧ����ʽ �� ÿ����3mol N2ʱ��ת�Ƶ���mol��
���𰸡�
��1��2s22p3��10���Ǽ���
��2��ȡ������ˮ���Թ���,�μӷ�̪��Һ,��Һ�ʺ�ɫ�����Թ��м�����������茶���,��,����笠�����Ũ������,����Һ������������Ũ�ȼ�С,����Һ�ĺ�ɫ��dz,֤����ˮ������
��3��NH4+��Cl����NH3?H2O
��4��ʪ��ĺ�ɫʯ����ֽ����
��5��2NaN3![]() 2Na+3N2��2
2Na+3N2��2
���������⣺��1����ԭ��Ϊ7��Ԫ�����������Ӳ㣬�����5�����ӣ��ݴ���д���������Ų�ʽΪ��2s22p3�������ӣ�N3���������8�����ӣ���Ϻ�������Ų������˶�״̬��ͬ�ĵ��ӣ�ԭ�Ӻ���û�������˶�״̬��ȫ��ͬ�ĵ��ӣ��м������Ӿ��м����˶�״̬�������ӣ�N3���������� 10���˶�״̬��ͬ�ĵ��ӣ�N4������P4�ṹ���ƣ�Ϊ�������幹�ͣ�N4������Nԭ���γ�3���Ҽ�������1�Թ¶Ե��ӣ��ӻ������ĿΪ4��ÿ����Ϊ�������Σ�Ϊ�Ǽ��Է��ӣ�
���Դ��ǣ�2s22p3��10���Ǽ��ԣ���2����֤��һˮ�ϰ���ˮ��Һ�ﲿ�ֵ��룬��˵��һˮ�ϰ���������ʣ�
����ѡ���Լ�Ϊ����̪������李�һˮ�ϰ���
��������������Ϊ��ȡ������ˮ���Թ��У��μӷ�̪��Һ����Һ�ʺ�ɫ�����Թ��м�����������茶��壬������笠�����Ũ����������Һ������������Ũ�ȼ�С������Һ�ĺ�ɫ��dz�����������֪����ˮ�д��ڵ���ƽ�⣬֤����ˮ�����
���Դ��ǣ�ȡ������ˮ���Թ��У��μӷ�̪��Һ����Һ�ʺ�ɫ�����Թ��м�����������茶��壬������笠�����Ũ����������Һ������������Ũ�ȼ�С������Һ�ĺ�ɫ��dz��֤����ˮ�������3����100mL 0.1mol/L��������ͨ��0.02mol������������Ӧ�����Ȼ�泥��õ���Ũ�ȵ�NH3H2O��NH4Cl�����Һ��������պ�����Һ�ʼ��ԣ�һˮ�ϰ��������笠�����ˮ�⣬��Һ��NH3H2O��NH4+��Cl�������������ʵ���Ũ�ȴ�С��ϵΪ��NH4+��Cl����NH3H2O��
���Դ��ǣ�NH4+��Cl����NH3H2O����4�������Ӧ���ɰ�������������Ψһ�ļ������壬��ʹʪ��ĺ�ɫʯ����ֽ����������ij��Һ����NaOH���ȣ������ܹ�ʹʪ��ĺ�ɫʯ����ֽ��������ɫ���壬��������Ϊ�����������Һ��һ������NH4+��
���Դ��ǣ�ʪ��ĺ�ɫʯ����ֽ��������5���������ƣ�NaN3��ײ����30������Ѹ�ٷֽ�Ϊ���ֵ��ʣ��������غ㶨�ɣ���Ӧǰ��Ԫ������䣬���ֵ���Ϊ�ƺ͵�������Ӧ�Ļ�ѧ����ʽΪ��2NaN3 ![]() 2Na+3N2������3molN2����ת��2mol��
2Na+3N2������3molN2����ת��2mol��
���Դ��ǣ�2NaN3 ![]() 2Na+3N2��2��
2Na+3N2��2��
�����㾫����������Ҫ�����˵���Ԫ�ؼ������֪ʶ�㣬��Ҫ����ԭ�ӽṹ�ص���ͬ�㣺������������Ϊ5����ͬ�㣺���Ӳ�����ͬ������ȷ�����⣮

 ������ȫ��������ϵ�д�
������ȫ��������ϵ�д�����Ŀ�����û�ѧԭ�����ԶԹ����ŷŵķ�ˮ�������Ƚ�����Ч��⣮ij�������Ƹ���ҵ������Cr�������������ù������£������Һ�н���������Ҫ��Cr3+ �� �����Fe3+ �� Fe2+ �� Al3+ �� Ca2+ �� Mg2+�� 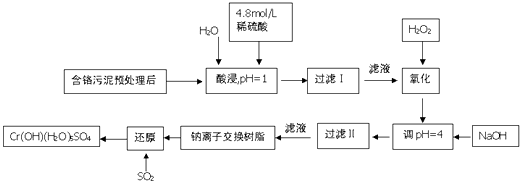
�����²��������ӵ����������γɳ���ʱ��Һ��pH���±���
������ | Fe3+ | Fe2+ | Mg2+ | Al3+ | Ca2+ | Cr3+ |
��ʼ����ʱ��pH | 1.9 | 7.0 | 9.6 | 4.2 | 9.7 | �� |
������ȫʱ��pH | 3.2 | 9.0 | 11.1 | 8.0 | 11.7 | 9.0����9.0�ܽ⣩ |
��1�����ʱ��Ϊ����߽�ȡ�ʿɲ�ȡ�Ĵ�ʩ��������һ����
��2����pH=4.0��Ϊ�˳�ȥ����Fe3+ �� Al3+ �� Ca2+ �� Mg2+��
��3�������ӽ�����֬��ԭ��ΪMn++n NaR��MRn+nNa+ �� ����������������������Fe3+ �� Al3+ �� Ca2+ �� Mg2+��
��4������ƽ����������ԭ��Ӧ����ʽ��Na2Cr2O7+SO2+H2O=Cr��OH����H2O��5SO4+Na2SO4 ��
����Ŀ�����ĵ��ʼ��仯�������ʶ�������;�㷺�� ���������գ�
��1����ѧ�������о����ô������������ٷɻ�β���е�NO��COת���CO2��N2��2NO+2CO ![]() 2CO2+N2+Q��Q��0�� ij�¶��²�ø÷�Ӧ�ڲ�ͬʱ���COŨ�������
2CO2+N2+Q��Q��0�� ij�¶��²�ø÷�Ӧ�ڲ�ͬʱ���COŨ�������
ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
c��CO�� | 3.60��10��3 | 3.05��10��3 | 2.85��10��3 | 2.75��10��3 | 2.70��10��3 | 2.70��10��3 |
�÷�Ӧƽ�ⳣ��K�ı���ʽΪ���¶����ߣ�Kֵ��ѡ���������С���������䡱����ǰ2s�ڵ�ƽ����Ӧ����v��N2��=����������Ӧ���ܱ������з������ﵽƽ��ʱ�����NOת���ʵĴ�ʩ֮һ�� ��
��2����ҵ�ϳɰ��ķ�Ӧ�¶�ѡ��500�����ҵ�ԭ���� ��
��3��ʵ�����ڹ̶��ݻ����ܱ������м���1mol������3mol����ģ�ҵ�ϳɰ�����Ӧ��һ���������Ѵﵽƽ��ı�־�� �� a��N2��H2��NH3��Ũ��֮��Ϊ1��3��2
b�������ڵ�ѹǿ���ֲ���
c��N2��H2��NH3��Ũ�Ȳ��ٷ����仯
d����Ӧֹͣ�������淴Ӧ�����ʶ�������
��4����������1mol���ʵ�ϡ�����л���ͨ��1mol NH3����Һ����仯���Բ��ƣ�����Ӧ��������Һ������Ũ���ɴ�С��˳��������ͨ��NH3�Ĺ�������Һ�ĵ���������ѡ��������С�������������䡱����