题目内容
13.下列说法正确的是( )| A. | 形成离子键的阴、阳离子间只存在静电吸引力 | |
| B. | HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱 | |
| C. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 | |
| D. | 元素周期律是元素原子核外电子排布周期性变化的结果 |
分析 A.形成离子键的阴、阳离子间存在静电吸引与静电排斥;
B.非金属性越强,其氢化物越稳定,对应氢化物的还原性越弱;
C.非金属性越强,最高价氧化物对应水化物的酸性越强;
D.原子结构中核外电子排布的周期性变化而引起元素的性质呈周期性变化.
解答 解:A.形成离子键的阴阳离子间存在静电吸引力和静电斥力,故A错误;
B.元素的非金属性越强,氢化物分子越稳定,还原性越弱,则HF、HCL、HBr、HI的热稳定性从左到右依次减弱,还原性依次增强,故B错误;
C.第三周期非金属元素的非金属从左到右逐渐增强,最高价氧化物对应水化物的酸性也逐渐增强,而含氧酸的酸性无此规律,故C错误;
D.原子结构中核外电子排布的周期性变化而引起元素的性质呈周期性变化,则元素的性质呈周期性变化的根本原因是核外电子排布的周期性变化,故D正确;
故选D.
点评 本题考查元素周期表和周期律的应用,为高频考点,把握元素的性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
3. H2C2O4为二元弱酸.20℃时,向0.100mol•L-1的H2C2O4溶液中逐量加入NaOH固体(不考虑溶液体积变化),溶液中部分微粒的物质的量浓度随pH的变化如图所示.则下列指定溶液中微粒物质的量浓度的关系一定正确的是( )
H2C2O4为二元弱酸.20℃时,向0.100mol•L-1的H2C2O4溶液中逐量加入NaOH固体(不考虑溶液体积变化),溶液中部分微粒的物质的量浓度随pH的变化如图所示.则下列指定溶液中微粒物质的量浓度的关系一定正确的是( )
 H2C2O4为二元弱酸.20℃时,向0.100mol•L-1的H2C2O4溶液中逐量加入NaOH固体(不考虑溶液体积变化),溶液中部分微粒的物质的量浓度随pH的变化如图所示.则下列指定溶液中微粒物质的量浓度的关系一定正确的是( )
H2C2O4为二元弱酸.20℃时,向0.100mol•L-1的H2C2O4溶液中逐量加入NaOH固体(不考虑溶液体积变化),溶液中部分微粒的物质的量浓度随pH的变化如图所示.则下列指定溶液中微粒物质的量浓度的关系一定正确的是( )| A. | Na2C2O4溶液中:2c(C2O42-)>c(Na+) | |
| B. | pH=5的溶液中:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(C2O42-) | |
| C. | c(HC2O4-)=c(C2O42-)的溶液中:c(Na+)>0.100mol•L-1+c(HC2O4-) | |
| D. | c(Na+)=0.100mol•L-1的溶液中:c(H+)-c(OH-)=c(C2O42-)-c(H2C2O4) |
4.链型的不饱和油酸(C17H33COOH)与蔗糖反应可以制得非天然油脂,其反应示意图如图所示(图中的反应式不完整),则下列说法不正确的是( )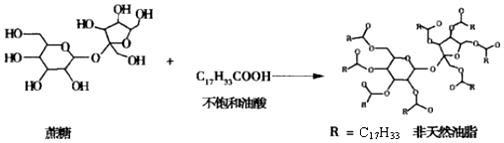

| A. | 蔗糖、葡萄糖分别与银氨溶液水浴加热反应,有相同的实验现象 | |
| B. | 天然油脂、蔗糖、非天然油脂都能发生水解反应 | |
| C. | 该非天然油脂与氢氧化钠溶液共热,产物可与溴的四氯化碳溶液反应 | |
| D. | 植物油、非天然油脂都可以与H2发生加成反应 |
1.下列关于基本营养物质的说法正确的是( )
| A. | 糖类、油脂、蛋白质都是由C、H、O三种元素组成的 | |
| B. | 葡萄糖和蔗糖不是同分异构体,但属于同系物 | |
| C. | 所有蛋白质均可通过颜色反应来鉴别 | |
| D. | 油脂在酸性条件下水解生成丙三醇和高级脂肪酸 |
8.从化学键的角度看化学反应的实质是“旧化学键的断裂,新化学键的形成”下列既有旧化学键的断裂,又有新化学键的形成的变化( )
| A. | 酒精溶于水 | B. | 水冻成冰 | ||
| C. | 氯化钠受热熔化 | D. | 氧化钙作为干燥剂吸水 |
18.下列物质发生所述的变化时,所克服的微粒间作用力,属于同类型的是( )
| A. | 干冰和I2(s)的升华 | |
| B. | NaBr和HI分别在水中电离 | |
| C. | 二氧化硅和生石灰的熔化 | |
| D. | 将氯化氢和有机溶剂四氯化碳分别加入水中 |
5.在恒温恒容的密闭容器中,对于某储氢反应:MHx(s)+yH2(g)?MHx+2y(s)△H<0达到平衡状态的标志是( )
| A. | 容器内气体压强保持不变 | |
| B. | 吸收y mol H2只需1 mol MHx | |
| C. | 若降温,该反应的平衡常数减小 | |
| D. | 若向容器内通入少量氢气,则v(放氢)>v(吸氢) |
2.下列关于碱金属元素(M)的单质及其化合物说法不正确的是( )
| A. | 随核电荷数递增单质的熔点依次降低、硬度依次减小 | |
| B. | 化合物中M的化合价均为+1价 | |
| C. | 单质在空气中都剧烈反应,生成M2O2 | |
| D. | 随核电荷数递增单质与水反应的剧烈程度越大 |
17.下列金属冶炼的反应原理错误的是( )
| A. | 2KCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2K+Cl2↑ | B. | CuO+C$\frac{\underline{\;高温\;}}{\;}$Cu+CO↑ | ||
| C. | MgO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Mg+H2O | D. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ |