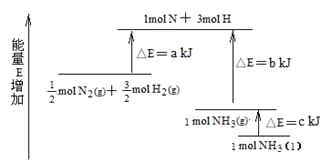
题目内容
【题目】M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,该化合物有漂白性,能使品红溶液褪色,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(1)Z原子的价电子排布式是 ,X和Y中电负性较大的是 (填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是 。
(3)X与M形成的XM3分子的空间构型是 ,中心原子的杂化轨道类型 为 。
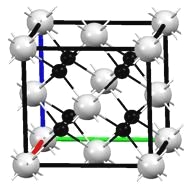
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如下图所示,则图中黑球代表的离是____________(填离子符号)。
【答案】(1)3d54s1;Cl(2)H2O分子间存在氢键,而H2S分子间没有氢键
(3)平面正三角形(或平面三角形);sp2 (4)Na+
【解析】试题分析:M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s轨道电子数的2倍,所以M是O;R是同周期元素中最活泼的金属元素,原子序数大于氧元素,则R是Na;X和M形成的一种化合物是引起酸雨的主要大气污染物,该化合物有漂白性,能使品红溶液褪色,化合物是SO2,则X是S,因此Y是Cl;Z的基态原子4s和3d轨道半充满,因此Z是24号元素Cr。
(1)Cr原子的价电子排布式是3d54s1;S的非金属性弱于Cl,因此X和Y中电负性较大的是Cl。
(2)由于H2O分子间存在氢键,而H2S分子间没有氢键,所以S的氢化物的沸点低于与其组成相似的O的氢化物。
(3)X与M形成的SO3分子中价层电子对数=![]() ,不含有孤对电子,因此其空间构型是平面正三角形,中心原子的杂化轨道类型为sp2。
,不含有孤对电子,因此其空间构型是平面正三角形,中心原子的杂化轨道类型为sp2。
(4)M和R所形成的一种离子化合物Na2O晶体的晶胞如下图所示,晶胞中含有的白球个数=![]() ,黑球全部在晶胞中,共计是8个,所以图中黑球代表的是Na+。
,黑球全部在晶胞中,共计是8个,所以图中黑球代表的是Na+。