题目内容
【题目】化学反应N2+3H2![]() 2NH3的能量变化下图所示,该反应的热化学方程式是
2NH3的能量变化下图所示,该反应的热化学方程式是
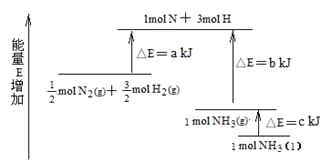
A. N2(g)+3H2(g)![]() 2NH3(1);△H=2(a-b-c)kJ·mol-1
2NH3(1);△H=2(a-b-c)kJ·mol-1
B. N2(g)+3H2(g)![]() 2NH3(g);△H=2(b-a)kJ·mol-1
2NH3(g);△H=2(b-a)kJ·mol-1
C. 1/2N2(g)+ 3/2H2(g)![]() NH3(1);△H=(b+c-a)kJ·mol-1
NH3(1);△H=(b+c-a)kJ·mol-1
D. 1/2N2(g)+3/2H2(g)![]() NH3(g);△H=(a+b)kJ·mol-1
NH3(g);△H=(a+b)kJ·mol-1
【答案】A
【解析】试题分析:由图可以看出,△E为反应的活化能,反应热等于反应物的活化能减生成物的活化能,
所以1/2N2(g)+ 3/2H2(g)═NH3(g)△H=(a-b)kJ/mol,即N2(g)+3H2(g)═2NH3(g) △H=-2(b-a)kJ/mol,故BD错误;而1mol的NH3(g)转化为1mol的NH3(l)放出的热量为ckJ,根据盖斯定律有:1/2N2(g)+ 3/2H2(g)═NH3(l)△H=(a-b-c)kJ/mol,即:N2(g)+3H2(g)=2NH3(1) △H=2(a-b-c)kJmol-1,故A正确,C错误;故选A。

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目