题目内容
要除去FeCl3溶液中的少量FeCl2杂质,可向其中加入适量的
| A.Fe | B.氯水 | C.盐酸 | D.NaOH溶液 |
B
解析试题分析:A、Fe不能与FeCl2反应,可以将FeCl3还原为FeCl2,错误;B、氯水不能与FeCl3反应,可以将FeCl2氧化为FeCl3,正确;C、盐酸不能与FeCl2反应,错误;D、NaOH既能与FeCl2反应,又能与FeCl3反应,错误。
考点:考查混合物的分离与提纯、Fe2+和Fe3+的重要化学性质等相关知识。

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
下列有关实验的做法错误的是
| A.分液时,分液漏斗中的上层液体应由上口倒出 |
| B.用加热的方法可区分碳酸钠和碳酸氢钠两种固体 |
| C.用渗析的方法可除去Fe(OH)3胶体中混有的Cl- |
| D.加入适量的NaOH可除去NaHCO3溶液中混有的少量Na2CO3 |
现有一块北方盐湖结晶析出的白色晶体.可能含有Na2CO3、Na2SO4、NaCl中的一种 或几种,为了证明其成分,加入试剂的正确顺序为
①加水溶解 ②加入足量的硝酸钡溶液 ③加入足量硝酸 ④加入硝酸银溶液
| A.①④②③ | B.①③②④ | C.④②①③ | D.④③②① |
如下图所示,利用海水可提取很多重要的化工原料。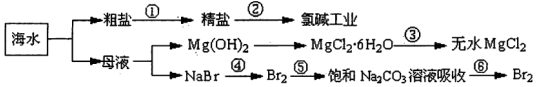
下列有关说法正确的是.( )。
| A.第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
| B.第②步中工业上可采用石墨为阴极,铁为阳极,采用阳离子交换膜的电解装置 |
| C.第③步中结晶出的MgCl2·6H2O可在空气中受热分解制无水MgCl2 |
| D.在第④步中溴元素被氧化,第⑤、⑥步中既有溴元素被氧化也有溴元素被还原 |
实验用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历下列过程,Fe3+在pH=5时已完全沉淀,其中分析错误的是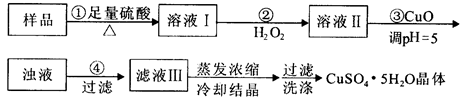
| A.利用CuCO3替代CuO也可调节溶液的pH,不影响实验结果 |
| B.步骤②中发生的主要反应为:H2O2+Fe2++2H+=Fe3++2H2O |
| C.洗涤晶体:向滤出晶体的漏斗中加少量水至浸没晶体,待自然流下后,重复2~3次 |
| D.配制240 mL1mol/L的CuSO4溶液,需称量CuSO4·5H2O的质量为62.5g |
下列有关实验原理或操作的示意图合理的是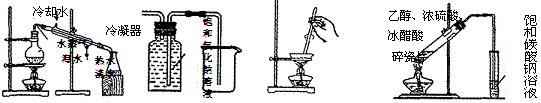
| A.制取蒸馏水 | B.收集氯化氢 | C.蒸发结晶 | D.实验室制取乙酸乙酯 |
某固体混合物可能含有NH4Cl、KOH、AgNO3、A1C13中的若干种,进行如下实验:
(1)加足量水溶解得澄清溶液
(2)往溶液中加入稀硝酸立即产生白色沉淀,加至过量,未见沉淀溶解根据上述实验,以下推断错误的是
| A.A1C13可能存在 | B.澄清溶液呈无色 |
| C.Ag (NH3)2+会在酸中离解 | D.澄清溶液中c (OH-)>c (Cl-) |
将下列各组物质提纯分离或除杂,可采用相同的实验方法和原理的是
| A.除去苏打中混有的少量小苏打杂质;除去氯化钠中混有的碘单质 |
| B.分离硝酸钾与氯化钠;分离氯化铁和氯化铜稀溶液 |
| C.除去二氧化碳中混有的少量二氧化硫;除去二氧化碳中混有的少量一氧化碳 |
| D.除去乙醛中溶有的少量乙酸;除去乙醇中溶有的少量苯酚 |
下列有关实验装置进行的相应实验,能达到实验目的的是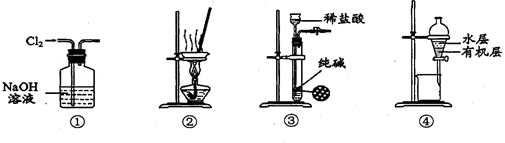
| A.用装置①除去Cl2中含有的少量HCl |
| B.用装置②从氯化铁溶液中直接蒸发结晶获得无水氯化铁 |
| C.用装置③制取少量纯净的CO2气体 |
| D.用装置④分离CCl4萃取碘水后已分层的有机层和水层 |