题目内容
实验用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历下列过程,Fe3+在pH=5时已完全沉淀,其中分析错误的是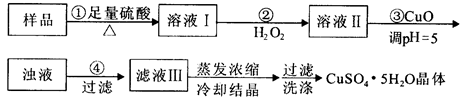
| A.利用CuCO3替代CuO也可调节溶液的pH,不影响实验结果 |
| B.步骤②中发生的主要反应为:H2O2+Fe2++2H+=Fe3++2H2O |
| C.洗涤晶体:向滤出晶体的漏斗中加少量水至浸没晶体,待自然流下后,重复2~3次 |
| D.配制240 mL1mol/L的CuSO4溶液,需称量CuSO4·5H2O的质量为62.5g |
B
解析试题分析:A、CuCO3和CuO都与溶液中H+反应,起到调节溶液pH的作用,并不引入新的杂质,故A正确; B、双氧水具有氧化性,能把溶液中的亚铁离子氧化生成铁离子,因此步骤②中发生的主要反应为:H2O2+2Fe2++2H+=2Fe3++2H2O,B不正确;C、固体具有吸附性,过滤时表面有可溶性物质,可向滤出晶体的漏斗中加少量水浸没晶体,自然流下,重复2-3次,可洗涤晶体,故C正确;D、实验室没有240ml容量瓶,所以配制240 mL1mol/L的CuSO4溶液,需要250ml容量瓶,因此需称量CuSO4·5H2O的质量为0.25L×1mol/L×250g/mol=62.5g,故D正确,答案选B。
考点:考查硫酸铜制备、过滤洗涤操作、物质的量的配制等

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示),下列有关说法不正确的是
| A.从能量转换角度来看,氯碱工业中的电解饱和食盐水是一个将电能转化为化学能的过程 |
| B.过程②中结晶出的MgCl2·6H2O要在HCl氛围中加热脱水制得无水MgCl2 |
| C.在过程③⑤中溴元素均被氧化 |
| D.除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为: |
现有MgCl2、AlCl3、CuCl2、FeCl3、NH4Cl五种溶液,如果只用一种试剂把它们鉴别开来,应选用的试剂是( )
| A.浓NaOH溶液 | B.AgNO3溶液 | C.氨水 | D.NaCl溶液 |
下图所示是分离混合物时常用的仪器,从左至右,可以进行的混合物分离操作分别是
| A.蒸馏、蒸发、萃取、过滤 | B.蒸馏、过滤、萃取、蒸发 |
| C.萃取、过滤、蒸馏、蒸发 | D.过滤、蒸发、萃取、蒸馏 |
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
| | 操作 | 现象 | 结论 |
| A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有SO42- |
| B | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+、无K+ |
| D | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
要除去FeCl3溶液中的少量FeCl2杂质,可向其中加入适量的
| A.Fe | B.氯水 | C.盐酸 | D.NaOH溶液 |
下列实验能达到目的的是
| A.将乙醇与浓硫酸共热制得的气体通入酸性KMnO4溶液中,检验气体中含有乙烯 |
| B.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,验证Na2CO3溶液中存在水解平衡 |
| C.淀粉溶液和稀H2SO4混合加热,加入新制Cu(OH)2悬浊液加热至沸腾,检验淀粉水解产物有还原性 |
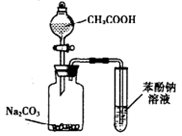
| D.利用如图装置并根据有关实验现象能推知酸性强弱:CH3COOH>C6H5OH>H2CO3 |
有一批做过银镜反应实验的试管要洗涤,可用铁盐溶液来做洗涤剂,因为Fe3+与Ag可发生可逆的氧化还原反应:Fe3+ + Ag  Fe2+ + Ag+。下列铁盐中洗涤效果最好的是
Fe2+ + Ag+。下列铁盐中洗涤效果最好的是
| A.FeCl3 | B.Fe2(SO4)3 | C.Fe2(CO3)3 | D.FeCl2 |
下列属于分离、提纯固态有机物的操作的是
| A.蒸馏 | B.萃取 | C.分液 | D.重结晶 |