题目内容
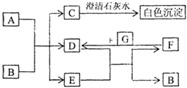 图中A~G均为中学化学中常见的物质,它们之间有如下转化关系.其中A、G为非金属单质,A为黑色固体、G为气态;D、F都是大气污染物,主要来源于汽车尾气,而且D为红棕色.请回答以下问题:
图中A~G均为中学化学中常见的物质,它们之间有如下转化关系.其中A、G为非金属单质,A为黑色固体、G为气态;D、F都是大气污染物,主要来源于汽车尾气,而且D为红棕色.请回答以下问题:(1)A元素在元素周期表中位于
第二
第二
周期ⅣA
ⅣA
族,C的化学式是CO2
CO2
.(2)写出D与E反应转化为F和B的化学方程式
3NO2+H2O=2HNO3+NO
3NO2+H2O=2HNO3+NO
.(3)在常温下,B的稀溶液也可与Cu反应生成F.此反应的离子方程式:
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
.分析:D、F都是大气污染物,主要来源于汽车尾气,推断为但氧化物,而且D为红棕色判断为NO2,F为NO,G为O2;C在转化关系中C和澄清石灰水反应生成碳酸钙沉淀,证明C为气体为CO2,D(NO2)+E=F(NO)+B,推断E为H2O,B为HNO3,A、G为非金属单质,A为黑色固体、G为气态,判断A为C,证明C为二氧化碳,符合转化关系;依据推断分析回答问题.
解答:解:D、F都是大气污染物,主要来源于汽车尾气,推断为但氧化物,而且D为红棕色判断为NO2,F为NO,G为O2;C在转化关系中C和澄清石灰水反应生成碳酸钙沉淀,证明C为气体为CO2,D(NO2)+E=F(NO)+B,推断E为H2O,B为HNO3,A、G为非金属单质,A为黑色固体、G为气态,判断A为C,证明C为二氧化碳;
(1)A元素为碳元素,在周期表中位置为第二周期第ⅣA族,C为CO2,故答案为:第二;ⅣA;CO2;
(2)D为NO2与EH2O反应转化为F(NO)和B(HNO3)的化学方程式为:3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO;
(3)常温下,B(HNO3)的稀溶液也可与Cu反应生成F(NO),反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(1)A元素为碳元素,在周期表中位置为第二周期第ⅣA族,C为CO2,故答案为:第二;ⅣA;CO2;
(2)D为NO2与EH2O反应转化为F(NO)和B(HNO3)的化学方程式为:3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO;
(3)常温下,B(HNO3)的稀溶液也可与Cu反应生成F(NO),反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
点评:本题考查了氮元素及其化合物性质的转化关系的分析判断,离子方程式的书写方法,碳和浓硝酸反应的产物分析是解题关键,题目难度中等.

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
| |||||||||||||||||||
 已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).


 (08黄冈中学二模)(15分)已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去)。
(08黄冈中学二模)(15分)已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去)。