题目内容
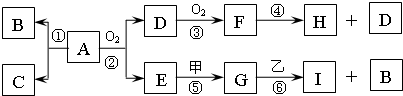
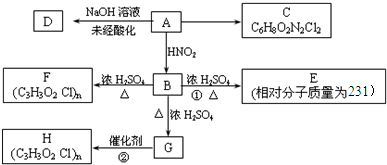
已知:A为四原子分子,且分子中共有22个电子;B、C为常见的气态单质,由A分解所得B、C的物质的量之比为1:3;E常温下呈液态;甲、乙为中学化学常见金属单质,常温下乙在H的浓溶液发生钝化现象;G、I的溶液均呈碱性.一定条件下各物质间的转化关系如图:
(1)写出单质C的电子式______.
(2)A极不稳定,受撞击发生分解放出大量的热而爆炸;A的水溶液呈弱酸性.
①从焓变和熵变的角度分析,一定条件下能否由B、C自发生成A______;
②写出Zn与A的水溶液反应的化学方程式______.
(3)反应④中每消耗1molF,转移电子的物质的量为______;
反应⑥的离子方程式是______.
解:E常温下呈液态,应为H2O,说明A中含有H元素,常温下乙在H的浓溶液发生钝化现象;G、I的溶液均呈碱性,可说明H为Al,则甲为Na,G为NaOH,乙为Al,I为NaAl(OH)4,B为H2,H为硝酸或硫酸,由F→H可知,H应为HNO3,则F为NO2,D为NO,则A中含有N元素,且A为四原子分子,且分子中共有22个电子,应为HN3,所以C为N2,
(1)由以上分析可知C为N2,电子式为 ,故答案为:
,故答案为: ;
;
(2)①合成HN3的反应为吸热、且熵减的反应,则△G=△H-T?△S>0,任何条件下不能自发进行,
故答案为:合成HN3的反应为吸热、且熵减的反应,任何条件下不能自发进行,故不能由B、C合成A;
②Zn与A的水溶液反应的化学方程式为Zn+2HN3=Zn(N3)2+H2↑,
故答案为:Zn+2HN3=Zn(N3)2+H2↑;
(3)反应④的方程式为3NO2+H2O=2HNO3+NO,每消耗3molNO2,转移电子的物质的量为2mol,则每消耗1molNO2,转移电子的物质的量为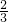 mol,反应⑥的离子方程式是2Al+6H2O+2OH-=2[Al(OH)4]-+3H2↑,
mol,反应⑥的离子方程式是2Al+6H2O+2OH-=2[Al(OH)4]-+3H2↑,
故答案为: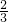 mol;2Al+6H2O+2OH-=2[Al(OH)4]-+3H2↑.
mol;2Al+6H2O+2OH-=2[Al(OH)4]-+3H2↑.
分析:E常温下呈液态,应为H2O,说明A中含有H元素,常温下乙在H的浓溶液发生钝化现象;G、I的溶液均呈碱性,可说明H为Al,则甲为Na,G为NaOH,乙为Al,I为NaAl(OH)4,B为H2,H为硝酸或硫酸,由F→H可知,H应为HNO3,则F为NO2,D为NO,则A中含有N元素,且A为四原子分子,且分子中共有22个电子,应为HN3,所以C为N2,结合对应物质的性质以及题目要求可解答该题.
点评:本题考查无机物的推断,侧重于元素化合物知识的综合应用,着重考查学生分析能力和化学知识的综合运用能量,注意从E和H作为该题的突破口进行解答,题目难度中等.
(1)由以上分析可知C为N2,电子式为
 ,故答案为:
,故答案为: ;
;(2)①合成HN3的反应为吸热、且熵减的反应,则△G=△H-T?△S>0,任何条件下不能自发进行,
故答案为:合成HN3的反应为吸热、且熵减的反应,任何条件下不能自发进行,故不能由B、C合成A;
②Zn与A的水溶液反应的化学方程式为Zn+2HN3=Zn(N3)2+H2↑,
故答案为:Zn+2HN3=Zn(N3)2+H2↑;
(3)反应④的方程式为3NO2+H2O=2HNO3+NO,每消耗3molNO2,转移电子的物质的量为2mol,则每消耗1molNO2,转移电子的物质的量为
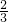 mol,反应⑥的离子方程式是2Al+6H2O+2OH-=2[Al(OH)4]-+3H2↑,
mol,反应⑥的离子方程式是2Al+6H2O+2OH-=2[Al(OH)4]-+3H2↑,故答案为:
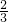 mol;2Al+6H2O+2OH-=2[Al(OH)4]-+3H2↑.
mol;2Al+6H2O+2OH-=2[Al(OH)4]-+3H2↑.分析:E常温下呈液态,应为H2O,说明A中含有H元素,常温下乙在H的浓溶液发生钝化现象;G、I的溶液均呈碱性,可说明H为Al,则甲为Na,G为NaOH,乙为Al,I为NaAl(OH)4,B为H2,H为硝酸或硫酸,由F→H可知,H应为HNO3,则F为NO2,D为NO,则A中含有N元素,且A为四原子分子,且分子中共有22个电子,应为HN3,所以C为N2,结合对应物质的性质以及题目要求可解答该题.
点评:本题考查无机物的推断,侧重于元素化合物知识的综合应用,着重考查学生分析能力和化学知识的综合运用能量,注意从E和H作为该题的突破口进行解答,题目难度中等.

练习册系列答案
相关题目



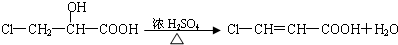
 HCO3-+OH-
HCO3-+OH- C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.