��Ŀ����
����Ŀ��A��B��C��D��E��FΪԭ��������������Ķ���������Ԫ�أ�A��Fԭ�ӵ�����������������������������Fԭ�ӵĵ��Ӳ�����A��3����Bԭ�Ӻ�����ӷִ�3����ͬ�ܼ���ÿ���ܼ��ϵĵ�������ͬ��A��C�γɵķ���Ϊ�����Σ�Dԭ��p����ϳɶԵĵ�����������δ�ɶԵĵ���������Eԭ�Ӻ���ÿ��ԭ�ӹ���ϵĵ��Ӷ��ѳɶԣ�E�縺��С��F��
��1��A��C�γɵķ��Ӽ�������ˮ����÷��ӻ�Ϊ�ȵ������������Ϊ ��
��2���Ƚ�E��F�ĵ�һ�����ܣ�E�������������F��
��3��BD2�ڸ��¸�ѹ�����γɵľ�����ͼ��ʾ���þ������������������ӡ���ԭ�ӡ������ӡ������������壬�þ�����Bԭ�ӵ��ӻ���ʽΪ �� 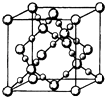
��4������F��ǿ����Һ��Ӧ��[F��OH��4]�����ɣ���[F��OH��4]���д���������ĸ���� a�����ۼ� b���Ǽ��Լ� c����λ�� d���Ҽ� e���м�
��5��Cu���������������壬�������ÿ����5��Cuԭ�ӽ��ܶ�������֪ÿ��Cuԭ�ӵ�����Ϊa g��Cuԭ�Ӱ뾶Ϊd cm����þ�����ܶ�Ϊgcm��3 �� ���ú�a��d�Ĵ���ʽ��ʾ��
���𰸡�
��1��H3O+
��2����
��3��ԭ�Ӿ��壻sp3
��4��acd
��5��![]()
���������⣺A��B��C��D��E��FΪԭ��������������Ķ���������Ԫ�أ�A��Fԭ�ӵ�����������������������������Fԭ�ӵĵ��Ӳ�����A��3������AΪ��Ԫ�أ�FΪ��Ԫ�أ�Bԭ�Ӻ�����ӷִ�3����ͬ�ܼ���ÿ���ܼ��ϵĵ�������ͬ����B�ĺ�������Ų�Ϊ1s22s22p2 �� BΪ̼Ԫ�أ�A��C�γɵķ���Ϊ�����Σ���C��ԭ����������B��F֮�䣬����CΪ��Ԫ�أ�Dԭ��p����ϳɶԵĵ�����������δ�ɶԵĵ�����������p�������4�����ӣ�����D��ԭ������С��F������D�ĺ�������Ų�Ϊ1s22s22p4 �� ����DΪ��Ԫ�أ�Eԭ�Ӻ���ÿ��ԭ�ӹ���ϵĵ��Ӷ��ѳɶԣ�E�縺��С��F����ԭ������С��F������EΪþԪ�أ���1��A��C�γɵķ��Ӽ�������ˮ�������ʽΪNH3 �� ���ݵȵ�����ԭ�����۵��Ӻ�ԭ����Ҫ�ֱ���ȣ�����д�����以Ϊ�ȵ������������Ϊ��H3O+ �� ���Դ��ǣ�H3O+����2��Mg��AlԪ�ض��ǵڶ����ڽ���Ԫ�أ�ͬһ����Ԫ��������ҵ�һ�����ܳ��������ƣ���MgԪ��ԭ��3S�ܼ��dz���״̬�������ϵͣ���һ�����ܸ���ͬ��������Ԫ�أ����Ե�һ������Mg��Al�����Դ��ǣ�������3������CO2�ڸ��¸�ѹ�����γɵľ����Ľṹͼ��֪���þ�������̼ԭ������ԭ��ֱ�ӹ��ɣ�̼ԭ������ԭ��֮��ͨ�����ۼ����ã��������־���Ϊԭ�Ӿ��壬ÿ��̼ԭ����Χ�����ĸ�C��O��������Cԭ�ӵĹ���ӻ���ʽΪsp3 �� ���Դ��ǣ�ԭ�Ӿ��壬sp3����4����[Al��OH��4]���У�������������������֮������λ�����ã����������ڲ������ż��Թ��ۼ�����Щ���ۼ����ǵ�����Ҳ���Ƕ��ǦҼ����ݴ��ж�acd��ȷ�����Դ��ǣ�acd����5��ͭ��������������������ÿ��ͭ�����к��е�ԭ�Ӹ���=8�� ![]() +6��
+6�� ![]() =4���������ÿ����5��Cuԭ�ӽ��ܶ�����Cu��ԭ�Ӱ뾶Ϊd cm���������������Խ��߳���Ϊ4dcm�����Ծ����ı߳�Ϊ
=4���������ÿ����5��Cuԭ�ӽ��ܶ�����Cu��ԭ�Ӱ뾶Ϊd cm���������������Խ��߳���Ϊ4dcm�����Ծ����ı߳�Ϊ ![]() ��4dcm=
��4dcm= ![]() dcm�����Ծ�����ܶ�
dcm�����Ծ�����ܶ� ![]() g/cm3=
g/cm3= ![]() g/cm3 �� ���Դ��ǣ�
g/cm3 �� ���Դ��ǣ� ![]() ��
��