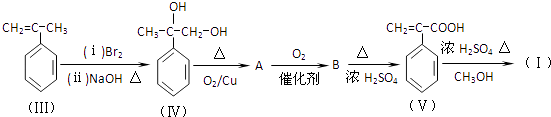
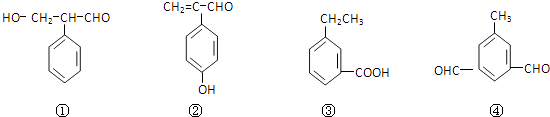
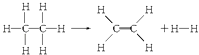
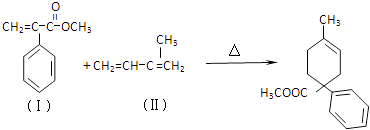题目内容
【题目】下列叙述正确的是( )
A.钠在空气中燃烧生成淡黄色的Na2O2
B.将SO2通入过量BaCl2溶液可生成BaSO3沉淀
C.新制氯水显酸性,向其中滴加少量紫色石蕊试液,振荡后溶液最终呈红色
D.点燃的镁条插入盛有CO2的集气瓶中,立即熄灭
【答案】A
【解析】解:A、钠在空气中燃烧生成的不是氧化钠,而是过氧化钠:2Na+O2 ![]() Na2O2 , Na2O2是淡黄色的固体,故A正确; B、强酸能制弱酸,而弱酸不能制出强酸.由于酸性H2SO3<HCl,故SO2不能和BaCl2反应制出HCl,即SO2不能和BaCl2反应,故B错误;
Na2O2 , Na2O2是淡黄色的固体,故A正确; B、强酸能制弱酸,而弱酸不能制出强酸.由于酸性H2SO3<HCl,故SO2不能和BaCl2反应制出HCl,即SO2不能和BaCl2反应,故B错误;
C、新制氯水中含HCl、HClO和未完全反应完的Cl2 , 导致氯水有酸性、强氧化性、漂白性和不稳定性.故向其中滴加少量紫色石蕊试液,振荡后溶液先变红色后褪色,体现氯水的酸性和漂白性,故C错误;
D、镁条能在CO2中燃烧生成氧化镁和碳:2Mg+O2 ![]() 2MgO+C,故镁条不会熄灭,从此也可看出,不能用CO2来灭镁火,故D错误;
2MgO+C,故镁条不会熄灭,从此也可看出,不能用CO2来灭镁火,故D错误;
故选A.
【考点精析】根据题目的已知条件,利用氯气的化学性质和钠的化学性质的相关知识可以得到问题的答案,需要掌握氯气的化学性质:与金属反应将金属氧化成高价态;非金属反应;与水反应;与碱反应;与还原性物质反应;钠的化学性质:与非金属反应;与水反应;与酸反应;与盐溶液反应.

练习册系列答案
 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目