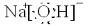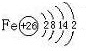题目内容
已知在高温条件下铝粉和Fe3O4粉末可以发生置换反应.现将铝粉和Fe3O4粉末的均匀混合物分成两等份:一份在高温下恰好完全反应后,再与足量的盐酸反应;一份直接放入足量的烧碱溶液中充分反应.前后两种情况下生成的气体质量比是( )
| A、1:1 | B、4:3 | C、3:4 | D、8:9 |
分析:把铝粉和Fe3O4粉末混合物,分成两等份,一份在高温下恰好完全反应生成铁与氧化铝,由电子转移守恒可知
n(Fe)=3n(Al),然后将生成物与足量的稀盐酸反应,铁与盐酸反应生成氯化亚铁与氢气,由电子转移守恒可知n(H2)=n(Fe);令一份直接加入足量的NaOH溶液使之充分反应,铝与氢氧化钠反应生成偏铝酸钠与氢气,由电子转移守恒可知2n′(H2)=3n(Al),据此计算判断.
| 8 |
| 3 |
解答:解:把铝粉和Fe3O4粉末混合物,分成两等份,一份在高温下恰好完全反应生成铁与氧化铝,由电子转移守恒可知
n(Fe)=3n(Al),然后将生成物与足量的稀盐酸反应,铁与盐酸反应生成氯化亚铁与氢气,由电子转移守恒可知n(H2)=n(Fe),所以n(H2)=
n(Al);
令一份直接加入足量的NaOH溶液使之充分反应,铝与氢氧化钠反应生成偏铝酸钠与氢气,由电子转移守恒可知2n′(H2)=3n(Al),所以n′(H2)=
n(Al).
故两种情况下生成气体的物质的量之比为n(H2):n′(H2)=
n(Al):
n(Al)=3:4,质量比等于物质的量之比应是3:4,
故选:C.
| 8 |
| 3 |
| 9 |
| 8 |
令一份直接加入足量的NaOH溶液使之充分反应,铝与氢氧化钠反应生成偏铝酸钠与氢气,由电子转移守恒可知2n′(H2)=3n(Al),所以n′(H2)=
| 3 |
| 2 |
故两种情况下生成气体的物质的量之比为n(H2):n′(H2)=
| 9 |
| 8 |
| 3 |
| 2 |
故选:C.
点评:本题考查混合物的计算、根据方程式的计算,难度中等,本题采取电子转移守恒计算,比根据方程式简单容易,清楚反应过程是关键,注意混合物的计算中守恒的运用.

练习册系列答案
相关题目