题目内容
【题目】已知某离子晶体的晶胞示意图如下图所示,其摩尔质量为M g·mol-1,阿伏加德罗常数的值为NA,晶体的密度为d g·cm-3。

下列说法中正确的是
A. 晶体晶胞中阴、阳离子的个数都为1
B. 晶体中阴、阳离子的配位数都是4
C. 该晶胞可能是NaCl的晶胞
D. 该晶体中两个距离最近的阳离子的核间距为M/d cm
【答案】C
【解析】
A、用均摊法分析,晶体晶胞中阴、阳离子的个数都为4,故A项错误。
B、阴、阳离子的配位数都是6,故B项错误。
C、该晶胞符合NaCl晶胞的特征,故C项正确。
D、根据氯化钠的晶胞结构图进行计算:设晶胞边长为a cm,则两个距离最近的阳离子的核间距离为a cm,4×M=NA·a3·d,可求出a,进而求得核间距,故D项错误。
综上所述,本题应选C。

 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案【题目】研究含氮化合物对能源、环保和生产具有重要的意义。请回答下列问题:
(1)在2 L密闭容器内, 800 ℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
①如图所示A点处v正___(填“>”、“<”或“=”,下同)v逆,A点处v正___B点处v正。
②如图所示的曲线,其中表示NO2的变化的曲线是________(填a、b、c、d等字母)。用O2表示2 s内该反应的速率v=________。
(2)已知化学反应N2+3H2![]() 2NH3的能量变化如图所示,
2NH3的能量变化如图所示,
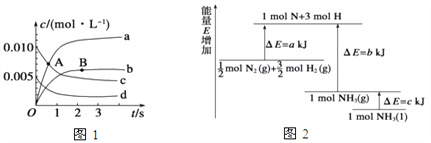
则,1 mol N和3 mol H生成1 mol NH3(g)是______能量的过程(填“吸收”或“释放”),由![]() mol N2(g)和
mol N2(g)和![]() mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)_______kJ能量(用含字母a、b、c的关系式表达)。
mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)_______kJ能量(用含字母a、b、c的关系式表达)。
【题目】为了测定实验室长期存放的Na2SO3固体的纯度,准确称取M g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案I:取50.00 mL上述溶液→加入足量的盐酸酸化的BaCl2溶液→操作I→洗涤→操作Ⅱ→称量,得到沉淀的质量为m1 g
方案Ⅱ:取50.00 mL上述溶液,用a mol/L 的酸性KMnO4溶液进行滴定。
实验中所记录的数据如下表:
滴定次数 实验数据 | 1 | 2 | 3 | 4 |
待测溶液体积/mL | 50.00 | 50.00 | 50.00 | 50.00 |
滴定管初读数/mL | 0.00 | 0.20 | 0.10 | 0.15 |
滴定管末读数/mL | 20.95 | 21.20 | 20.15 | 21.20 |
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、滴管、药匙和_______________、_________________。
(2)操作I为__________________操作Ⅱ为______________
(3)方案I中如何判别加入的氯化钡已经过量______________________________
(4)在方案Ⅱ中滴定终点的判断方法是_______________________________。
(5) 在方案Ⅱ中发生的离子反应方程式为__________________________
(6)根据方案Ⅱ所提供的数据,计算Na2SO3的纯度为___________。(写成分数形式)
(7)有同学模仿方案I,提出方案Ⅲ:取50.00 mL上述溶液→加入足量的盐酸酸化的Ba(NO3)2溶液→操作I→洗涤→操作Ⅱ→称重,得到沉淀质量为m2 g 并用方案I的方法计算结果。
根据方案Ⅲ,从理论上讲,下列说法正确的是________(填序号)
a.方案I比方案Ⅲ的计算结果要低
b.方案I比方案Ⅲ的计算结果要高
c.m1=m2 ,方案I和方案Ⅲ的结果一样
d.方案Ⅲ不应根据方案I的方法计算
(8)上述实验中,由于操作错误所引起的实验误差分析正确的是__________(填序号)。
a.方案I中如果没有洗涤操作,实验结果将偏小
b.方案I中如果没有操作Ⅱ,实验结果将偏大
c.方案Ⅲ中如果没有洗涤操作,实验结果将偏小
d.方案Ⅲ中如果没有操作Ⅱ,实验结果将偏大