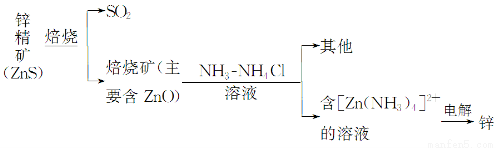
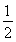题目内容
体积为1 L的某溶液中含有的离子如表所示:
离子 | Cu2+ | Al3+ | NO3- | Cl- |
| 1 | 1 | a | 1 |
用Pt电极电解该溶液,当电路中有3 mol电子通过时(忽略电解时溶液体积的变化及电解产物可能存在的溶解现象),下列说法正确的是 ( )。
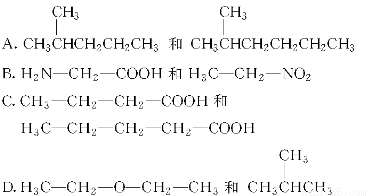
A.电解后溶液的pH=0
B.a=3
C.阳极生成1.5 mol Cl2
D.阴极析出的金属是铜与铝
A
【解析】根据离子的放电顺序及得失电子守恒知,先电解0.5 mol CuCl2,生成0.5 mol Cu和0.5 mol Cl2,然后电解0.5 mol Cu(NO3)2,生成0.5 mol Cu和0.25 mol O2、1 mol H+,再电解Al(NO3)3溶液(即电解水),溶液中c(H+)=1 mol·L-1,故A正确,D错误。阳极上Cl-放电只产生0.5 mol Cl2,C错误。由电荷守恒可知a=4,B错误。

某课外小组对一些金属单质和化合物的性质进行探究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
实验步骤 | 实验现象 |
将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
反应结束后分离出溶液备用 |
|
红色固体用蒸馏水洗涤后,置于潮湿空气中 | 一段时间后固体由红色变为绿色[设其主要成分为Cu2(OH)2CO3] |
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应_________________________________________________________;
化合反应_________________________________________________________。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可以观察到的现象是__________________________________________________。
解释此现象的离子方程式是___________________________________________。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼金属锰。
①用铝与软锰矿炼锰的原理是(用化学方程式来表示)________________________。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化的H2O2溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是_______________________。