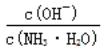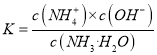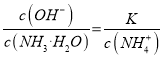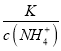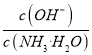题目内容
【题目】火力发电厂释放出大量氮的氧化物(NOx)、二氧化硫等气体会造成环境污染,对燃煤废气进行脱除处理。可实现绿色环保、低碳减排、废物利用等目的。
(1)己知:N2 (g) +O2 (g) =2NO (g) △H=+180.5kJ·mol-1
C (s) +O2 (g)=CO2 (g) △H=-393.5 kJ·mol-1
2C (s) +O2(g) =2CO (g)△H=-221 kJ·mol-1
若某反应的平衡常数表达式为: 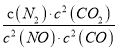 ,请写出此反应的热化学方程式_________。
,请写出此反应的热化学方程式_________。
(2)脱硝
利用甲烷与NO2反应,生成无污染的物质,则该反应的化学方程式为:___________。
(3)脱碳
将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H3
CH3OH(g)+H2O(g)△H3
①取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线(见如图1),则上述CO2转化为甲醇反应的△H3_____0(填“>”、“<”或“=”)。
②在一恒温恒容密闭容器中充入0.5molCO2和1.5molH2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如上图2所示.请回答:第10min后,若升温,该反应的平衡常数将_____(填“变大”、“变小”、“不变”);若向该容器中再充入1molCO2和3molH2再次达到平衡时,则CH3OH(g)的体积分数将___(“变大”、“变小”、“不变”)。
(4)脱硫
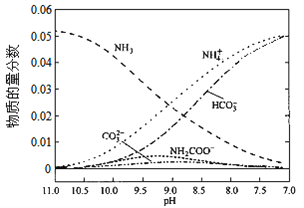
某种脱硫工艺中将废气经处理后,与一定量的氨气、潮湿的空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥.设烟气中的SO2、NO2的物质的量之比为1:1,则该反应的化学方程式为__________。若在0.1mol/L的硝酸铵溶液中加入等体积的0.09mol/L氨水,配制了pH=8.2的溶液,则该溶液中微粒浓度由大到小的顺序为______________。
【答案】 2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5kJ/mol CH4 + 2NO2 = N2 + CO2 + 2H2O < 变小 变大 12NH3+3O2+4SO2+4NO2+6H2O=4(NH4)2SO4+4NH4NO3 c(NH4+)> c(NO3﹣)> c(NH3H2O)> c(OH﹣)>c(H+)
【解析】(1)因为反应的平衡常数为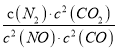 ,所以反应方程式为2NO(g)+2CO(g)=N2(g)+2CO2(g)。将第二个方程式扩大2倍,减去第一个方程式,再减去第三个方程式皆可以得到上面的反应,该反应的△H=2×(-393.5)-180.5-(-221)=-756.5 kJ/mol,所以热化学方程式为:2NO(g)+2CO(g)=N2(g)+2CO2(g)△ H=-746.5kJ/mol。
,所以反应方程式为2NO(g)+2CO(g)=N2(g)+2CO2(g)。将第二个方程式扩大2倍,减去第一个方程式,再减去第三个方程式皆可以得到上面的反应,该反应的△H=2×(-393.5)-180.5-(-221)=-756.5 kJ/mol,所以热化学方程式为:2NO(g)+2CO(g)=N2(g)+2CO2(g)△ H=-746.5kJ/mol。
(2)甲烷与NO2反应,生成无污染的物质,一定是得到CO2、N2和H2O,根据化合价升降相等和原子个数守恒得到方程式为:CH4 + 2NO2 = N2 + CO2 + 2H2O。
(3)①该图像是发生上述反应,反应相同时间后,再测体系中甲醇的体积分数,即不一定是平衡状态的体积分数。当温度比较低的时候,反应速率比较慢,则这个时间点上还没有达平衡,那么反应的速率越快,反应的量越多,甲醇的体积分数越大;当温度较高的时候,反应速率比较快,则这个时间点上应该已经达到平衡态,那么随着温度变化对平衡产生影响,甲醇的体积分数也会变化。根据以上理论,图像中右半边温度较高的区域是平衡移动导致甲醇的体积变化,温度升高肌醇体积分数降低,说明升温平衡逆向移动,正反应放热,即△H3<0。
②该反应放热,升高温度平衡常数减小。恒容,原来加入0.5molCO2和1.5molH2,再充入1molCO2和3molH2,就是同时同比例增大所有反应物的浓度,甲醇体积分数的变化相当于不加入物质,直接增大压强,增大压强平衡向正反应方向移动,甲醇的体积分数增大。
(4)根据题目表述反应物为氨气、二氧化硫、一氧化氮、水,生成物一定有硫酸铵和硝酸铵,所以得到部分反应方程式:NH3+O2+SO2+NO2+H2O→(NH4)2SO4+NH4NO3,因为烟气中的SO2、NO2的物质的量之比为1:1,所以将两者视为一个整体,化合价升高3价(S升高2价,N升高1价),O2降低4价,所以O2的系数为3,SO2、NO2的系数都是4。最后根据原子个数守恒配平即得:12NH3+3O2+4SO2+4NO2+6H2O=4(NH4)2SO4+4NH4NO3。若在0.1mol/L的硝酸铵溶液中加入等体积的0.09mol/L氨水,则溶液中硝酸铵的浓度为0.05mol/L,一水合氨的浓度为0.045mol/L,即开始时可以认为:c(NH4+)= c(NO3﹣)=0.05mol/L, c(NH3H2O)=0.045mol/L。溶液的pH=8.2,说明一水合氨的电离占主导地位。一水合氨电离为铵根离子,所以c(NH4+)> c(NO3﹣)> c(NH3H2O),明显溶液中一水合氨的电离程度较小,氢氧根的浓度应该远小于一水合氨的浓度,溶液显碱性有:c(OH﹣)>c(H+),所以有:c(NH4+)> c(NO3﹣)> c(NH3H2O)> c(OH﹣)>c(H+)。

【题目】一种从含Br-废水中提取Br2的过程,包括过滤、氧化、正十二烷萃取及蒸馏等步骤。己知:
Br2 | CCl4 | 正十二烷 | |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
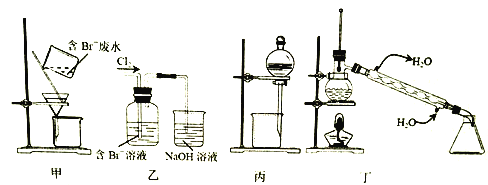
下列说法正确的是
A. 用甲装置过滤时,需不断搅拌
B. 丙装置中用正十二烷而不用CCl4,是因为其密度小
C. 用乙装置将Br-氧化为Br2
D. 可用装置丁进行蒸馏,先收集正十二烷再收集Br2