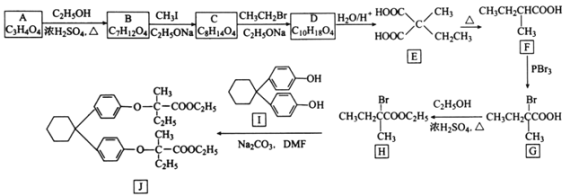
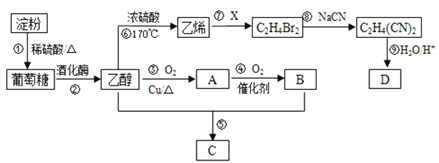
题目内容
【题目】下列有关Na2CO3和NaHCO3的说法正确的是( )
A.在水中溶解度:Na2CO3<NaHCO3
B.二者都能与盐酸反应生成CO2
C.热稳定性:Na2CO3<NaHCO3
D.二者在相同条件下可相互转化
【答案】B
【解析】
A.相同的温度下,NaHCO3溶解度比Na2CO3小,故A错误;
B.NaHCO3与盐酸反应较Na2CO3剧烈,但都能反应生成CO2,故B正确;
C.碳酸氢钠受热易分解,而碳酸钠不分解,则热稳定性为Na2CO3>NaHCO3,故C错误;
D.NaHCO3可与NaOH反应生成Na2CO3,而NaHCO3分解可生成Na2CO3,则不在相同条件下转化,故D错误;
故答案为B。

 阅读快车系列答案
阅读快车系列答案【题目】将高温水蒸气通到硫氰化钾的表面,会发生反应:4KSCN + 9H2O(g) → K2CO3 + K2S + 3CO2 + 3H2S + 4NH3完成下列填空:
(1)上述反应所涉及的各元素中,离子半径最大的是_____________(填离子符号);属于第二周期元素的非金属性由强到弱的顺序为_________________。
(2)上述反应所涉及的各物质中,属于非电解质的是_________________。
(3)写出CO2的电子式____________,其熔沸点低的原因是___________________________。
(4)已知物质的量浓度均为0.10 mol/L的K2CO3和K2S溶液pH如下:
溶液 | K2CO3 | K2S |
pH | 11.6 | 12.5 |
K2CO3水溶液呈碱性的原因是______________________________(用离子方程式表示)。从表中数据可知,K2CO3溶液中c(CO32-)_______K2S溶液中的c(S2—)(填“>”“<”或“=”)。
(5)K2S接触潮湿银器表面,会出现黑色斑点(Ag2S),其原理如下:____K2S + ____Ag + _____O2 + _____H2O → _____Ag2S + _____KOH
①配平上述反应________________。
②每消耗标准状况下224 mL O2,转移电子数目为_____________。
【题目】在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+ Y(g)![]() 2Z(g) △H<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) △H<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t / min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A. 该温度下此反应的平衡常数K = 1.44
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 反应前2 min的平均速率v(Z) = 2.0×10-3 mol/(L·min)
D. 其他条件不变,再充入0.2 mol X,平衡时Y的体积分数增大