题目内容
15.下列叙述中不正确的是( )| A. | 在离子化合物中也可能含有共价键 | |
| B. | 非金属元素的原子之间形成的化学键一定是共价键 | |
| C. | 含共价键的化合物不一定是共价化合物 | |
| D. | 含离子键的化合物一定是离子化合物 |
分析 一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,含离子键的一定为离子化合物,共价键可存在于单质、化合物中,以此来解答.
解答 解:A.离子化合物中也可能含有共价键,如NaOH含离子键、O-H共价键,故A正确;
B.非金属元素的原子之间形成的化学键可能为离子键,如铵盐中含离子键,故B错误;
C.含共价键的化合物可能为离子化合物,如NaOH含离子键、O-H共价键,故C正确;
D.含离子键的一定为离子化合物,可能含共价键,故D正确;
故选B.
点评 本题考查离子化合物与化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意结合实例分析,题目难度不大.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
13.半导体工业用石英砂作原料通过三个重要反应生产单质硅.
①SiO2(s)(石英砂)+2C(s)=Si(s)(粗硅)+2CO(g)△H=+682.44kJ•mol-1
②Si(s)(粗硅)+2Cl2(g)=SiCl4(1)△H2=-657.01kJ•mol-1
③SiCl(1)+2Mg(s)=2MgCl2(s)+Si(s)(纯硅)△H3=-625.63kJ•mol-1
生产1.00kg纯硅放出的热量为( )
①SiO2(s)(石英砂)+2C(s)=Si(s)(粗硅)+2CO(g)△H=+682.44kJ•mol-1
②Si(s)(粗硅)+2Cl2(g)=SiCl4(1)△H2=-657.01kJ•mol-1
③SiCl(1)+2Mg(s)=2MgCl2(s)+Si(s)(纯硅)△H3=-625.63kJ•mol-1
生产1.00kg纯硅放出的热量为( )
| A. | 24372.86 kJ | B. | 21.44 kJ | C. | 600.20 kJ | D. | 21435.71 kJ |
6.下列各对物质中属于同分异构体的是( )
| A. | ${\;}_6^{12}$C与${\;}_6^{13}$C | B. | O2与O3 | ||
| C. |  与 与 | D. | 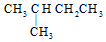 与 与 |
3.将二氧化硫通入下列试剂,能依次证明SO2具有还原性、漂白性、氧化性、酸性氧化物性质的是( )
①溴水
②品红溶液
③酸性高锰酸钾溶液
④硝酸钡溶液
⑤含酚酞的氢氧化钠溶液
⑥氢硫酸
⑦紫色石蕊试液
⑧氯化铁溶液.
①溴水
②品红溶液
③酸性高锰酸钾溶液
④硝酸钡溶液
⑤含酚酞的氢氧化钠溶液
⑥氢硫酸
⑦紫色石蕊试液
⑧氯化铁溶液.
| A. | ①⑤⑥④ | B. | ⑧②⑥⑤ | C. | ③⑦⑥⑤ | D. | ④②⑤① |
10.用石油和煤可以得到有机化工生产中需要的众多原料,例如由石油得到的乙烯和由煤得到的苯制聚苯乙烯.生产过程如下:
①CH2═CH2+ →
→
② $\stackrel{-H_{2}}{→}$
$\stackrel{-H_{2}}{→}$ 
③ →
→
下列说法不正确的是( )
①CH2═CH2+
 →
→
②
 $\stackrel{-H_{2}}{→}$
$\stackrel{-H_{2}}{→}$ 
③
 →
→
下列说法不正确的是( )
| A. | 通过裂解可以从石油中获得更多的乙烯 | |
| B. | 把煤干馏可以得到粗苯,经分馏可以得到苯 | |
| C. | 制聚苯乙烯的反应①为取代反应,②为消去反应③为加聚反应 | |
| D. | 反应①②③的原子利用率不都为100% |
20.下列有关比较顺序中,正确的是( )
| A. | 熔点:金刚石>晶体硅>冰>干冰 | B. | 电负性:N>O>F | ||
| C. | 熔点:CsCl>MgO>Na>K | D. | 沸点:C2H5SH>C2H5OH>CH3SH |
4.用海水制盐工业中的母液来生产金属镁的一种工艺流程如下:
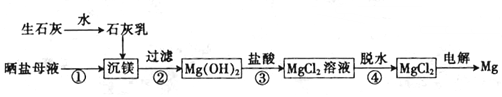
下列说法错误的是( )

下列说法错误的是( )
| A. | 上述工艺流程中未涉及置换反应 | |
| B. | 设计步骤①、②、③的主要目的是富集MgCl2 | |
| C. | 脱水时在HCl气氛中进行可防止MgCl2发生水解 | |
| D. | 电解得到的炽热镁粉可在二氧化碳气氛中冷却 |
19.锂电池是一代新型高能电池,它以质量轻、能量高而受到普遍重视,目前已成功研制多种锂电池.某种锂电池的总反应为Li+MnO2═LiMnO2,下列说法正确的是( )
| A. | Li是正极,电极反应为Li-e-═Li+ | |
| B. | Li是负极,电极反应为Li-2e-═Li2+ | |
| C. | MnO2是负极,电极反应为MnO2+e-═MnO2- | |
| D. | Li是负极,电极反应为Li-e-═Li+ |
 已知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似,如图,则硼氮苯的二氯取代物B2N3H4Cl2的同分异构的数目为( )
已知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似,如图,则硼氮苯的二氯取代物B2N3H4Cl2的同分异构的数目为( )