题目内容
19.在19题中发生的化学反应为:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O 反应中,被氧化盐酸和未被氧化盐酸的物质的量之比是( )| A. | 1﹕10 | B. | 10﹕1 | C. | 3﹕5 | D. | 5﹕3 |
分析 反应中盐酸起到氧化剂和酸性的所用,生成Cl2被氧化,生成KCl和MnCl2表现为酸性,以此解答该题.
解答 解:在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O反应中,当有16molHCl参加反应时,生成5molCl2,Cl元素化合价升高,被氧化,则被氧化的HCl为10mol,未被氧化的HCl为16mol-10mol=6mol,被氧化的HCl与未被氧化的HCl的物质的量之比为10mol:6mol=5:3,
故选D.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化及守恒法应用为解答的关键,侧重分析与计算能力的综合考查,题目难度不大.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
9.关于分散系和胶体的说法不正确的是( )
| A. | 分散质直径介于1~100 nm之间的分散系称为胶体 | |
| B. | 胶体、溶液、浊液都是分散系 | |
| C. | 利用丁达尔效应可以区别溶液与胶体 | |
| D. | 胶体粒子很小,可以透过半透膜 |
10.下列说法正确的是( )
| A. | 用核磁共振氢谱不能区分HCOOCH3和HCOOCH2CH3 | |
| B. | 室温下,在水中的溶解度:丙三醇>苯酚>1-氯丁烷 | |
| C. | 用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3 | |
| D. | 油脂在酸性或碱性条件下均可发生水解反应,且产物相同 |
7.下列变化需要加入还原剂才能实现的( )
| A. | MnO4-→Mn2+ | B. | HCO3-→CO2 | C. | Fe→Fe3+ | D. | HCl→Cl2 |
14.下列有关说法正确的是( )
| A. | 道尔顿提出了原子学说 | |
| B. | 波尔提出了“葡萄干面包式”的原子结构模型 | |
| C. | 卢瑟福提出核外电子在一系列稳定的轨道上运动时,既不放出能量,也不吸收能量 | |
| D. | 汤姆生提出了带核的原子结构模型 |
4.下列关于电离常数的说法正确的是( )
| A. | 电离常数随着弱电解质的浓度增大而增大 | |
| B. | CH3COOH的电离常数表达式为Ka=$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}$ | |
| C. | CH3COOH溶液中加入少量CH3COONa溶液,电离常数减小 | |
| D. | 电离常数只与温度有关,与浓度无关 |
8.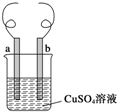 用铁丝(电极 a)、铜丝(电极 b)和CuSO4溶液可以构成原电池或电解池,如图所示.则下列说法正确的是( )
用铁丝(电极 a)、铜丝(电极 b)和CuSO4溶液可以构成原电池或电解池,如图所示.则下列说法正确的是( )
 用铁丝(电极 a)、铜丝(电极 b)和CuSO4溶液可以构成原电池或电解池,如图所示.则下列说法正确的是( )
用铁丝(电极 a)、铜丝(电极 b)和CuSO4溶液可以构成原电池或电解池,如图所示.则下列说法正确的是( )| A. | 构成原电池时 b 极反应为:Cu-2e-═Cu2+ | |
| B. | 构成电解池时 a 极质量一定减少 | |
| C. | 构成的原电池或电解池工作后都能产生大量气体 | |
| D. | 构成电解池时 b 极质量可能减少也可能增加 |