题目内容
用惰性电极电解下列溶液,其中随着电解的进行,溶液pH值逐渐减小的是( )
①氯化钠溶液 ②硫酸铜溶液 ③氢氧化钠溶液 ④稀硫酸 ⑤稀盐酸 ⑥硫酸钠溶液.
①氯化钠溶液 ②硫酸铜溶液 ③氢氧化钠溶液 ④稀硫酸 ⑤稀盐酸 ⑥硫酸钠溶液.
| A、①③⑤ | B、②④⑤ |
| C、②④ | D、②④⑥ |
考点:电解原理
专题:电化学专题
分析:电解液的pH值逐渐减小,阳极应是OH-离子放电,可为不活泼金属的含氧酸盐.
解答:
解;①氯化钠溶液电解是放氢生碱型,pH值变大;
②硫酸铜溶液电解是放氧生酸型,pH值变小;
③氢氧化钠溶液电解,是电解水型,氢氧化钠的浓度变大,pH值变大;
④稀硫酸电解,是电解水型,硫酸的浓度变大,pH值变小;
⑤稀盐酸,是电解电解质型,pH值变大;
⑥硫酸钠溶液显中性,是电解水型,硫酸钠的浓度变大,pH值不变;
故选C.
②硫酸铜溶液电解是放氧生酸型,pH值变小;
③氢氧化钠溶液电解,是电解水型,氢氧化钠的浓度变大,pH值变大;
④稀硫酸电解,是电解水型,硫酸的浓度变大,pH值变小;
⑤稀盐酸,是电解电解质型,pH值变大;
⑥硫酸钠溶液显中性,是电解水型,硫酸钠的浓度变大,pH值不变;
故选C.
点评:本题考查电解产物的判断以及溶液pH的计算,是高考中的常见考点,属于中等难度的试题.试题综合性强,注重解题的灵活性.该题的关键是记住常见离子的放电顺序,然后灵活分析、判断、应用即可.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
CH3COOCH2CH3分子内处于不同化学环境的氢原子种数(即核磁共振谱的峰数)为( )
| A、1 | B、2 | C、3 | D、4 |
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列叙述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列叙述正确的是( )| A、反应开始到10 s末时,用Z表示的反应速率为0.158 mol?L-1?s-1 |
| B、10 s后,该反应停止进行 |
| C、反应的化学方程式为X(g)+Y(g)═2Z(g) |
| D、反应开始到10 s时,Y的转化率为79.0% |
已知反应3H2+N2?2NH3为放热反应,由此推断出( )
| A、氢气和氮气在常温常压下,不需要任何能量就可以迅速发生反应 |
| B、3mol氢气和1mol氮气所具有的总能量低于2mol氨气所具有的总能量 |
| C、断裂1mol N≡N键和3mol H-H键吸收的能量小于形成6mol N-H键所放出的能量 |
| D、氢气和氮气是高能极不稳定的物质,氨气是低能且非常稳定的物质 |
下列叙述中,错误的是( )
| A、甲苯与氯气在光照下反应主要生成2,4-二氯甲苯 |
| B、苯乙烯在合适条件下催化加氢可生成乙基环己烷 |
| C、乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷 |
| D、苯与浓硝酸、浓硫酸共热并保持55-60℃反应生成硝基苯 |
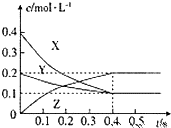 在25℃时,密闭容器中X、Y、Z三种气体的浓度变化情况如图,下列说法错误的是( )
在25℃时,密闭容器中X、Y、Z三种气体的浓度变化情况如图,下列说法错误的是( )| A、反应可表示为3X+Y?2Z |
| B、从反应开始到0.4s时,以Y表示的化学反应速率为:0.25mol?L-1?s-1 |
| C、增大压强使平衡向生成Z的方向移动,平衡常数增大 |
| D、升高温度,平衡常数可能增大也可能减小 |
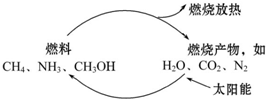 能是当今社会发展的三大支柱之一,有专家提出:如果对燃料燃烧产物如CO2、H2O、N2等利用太阳能让它们重新组合,使之能够实现下图所示循环,那么不仅可以消除燃烧产物对大气的污染,还可节约燃料,缓解能危机.在此构想的物质循环中太阳能最终转化为( )
能是当今社会发展的三大支柱之一,有专家提出:如果对燃料燃烧产物如CO2、H2O、N2等利用太阳能让它们重新组合,使之能够实现下图所示循环,那么不仅可以消除燃烧产物对大气的污染,还可节约燃料,缓解能危机.在此构想的物质循环中太阳能最终转化为( )