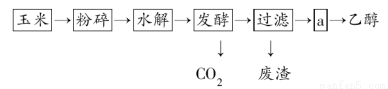
题目内容
室温下,取0.2 mol·L-1CH3COOH溶液与0.2 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则下列说法(或关系式)正确的是( )
A.混合溶液中由水电离出的c(H+)=10-8 mol·L-1
B.溶液中离子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.混合溶液中c(Na+)=c(CH3COOH)+c(CH3COO-)=0.2 mol·L-1
D.混合溶液中c(OH-)-c(CH3COOH)=c(H+)=1×10-8 mol·L-1
D
【解析】混合后反应恰好生成CH3COONa,溶液pH=8说明水解显碱性,盐的水解促进水的电离,A错误。溶液中CH3COO-水解,浓度减小,所以c(Na+)>c(CH3COO-),B错误。混合后溶液稀释1倍,c(Na+)=0.1 mol/L,C错误。因CH3COO-+H2O??CH3COOH+OH-,水解产生的OH-和CH3COOH相等。所以,c(OH-)-c(CH3COOH)是水电离出的c(OH-)与c(H+)相等,D正确。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案某研究性学习小组为了探究醋酸的电离情况,进行了如下实验:
实验一 配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol·L-1的醋酸溶液,用0.2 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250 mL 0.2 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、________和________。
(2)为标定某醋酸溶液的准确浓度,用0.2000 mol·L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
则该醋酸溶液的准确浓度为________。(保留小数点后四位)
实验二 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
醋酸浓度(mol·L-1) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
回答下列问题:
(1)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是:____________________。
(2)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度将________。(填“增大”“减小”或“不变”)
实验三 探究温度对醋酸电离程度的影响
请你设计一个实验完成该探究,请简述你的实验方案:____________。