题目内容
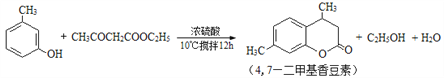
【题目】4,7—二甲基香豆素(熔点:132.6℃)是一种重要的香料。由间甲苯酚为原料合成4,7—二甲基香豆素的反应如下:
实验装置图如下:
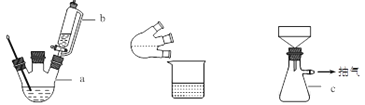
主要实验步骤:
步骤1:向装置a中加入60 mL浓硫酸,并冷却至0℃以下,搅拌下滴入间甲苯酚30 mL(0.29 mol)和乙酰乙酸乙酯26.4 mL(0.21 mol)的混合物。
步骤2:保持10℃,搅拌12 h,反应完全后,将其倒入冰水混合物中,然后抽滤、水洗得粗产品。
步骤3:粗产品用乙醇溶解并重结晶,得白色针状晶体并烘干,称得产品质量为33.0 g。
(1)简述装置b中将活塞上下部分连通的目的_____________。
(2)装置c的名称为_____________,与过滤相比,抽滤的优点是_____________。
(3)浓硫酸需要冷却至0℃以下的原因是_____________。
(4)反应需要搅拌12 h,其原因是_____________。
(5)本次实验产率为_____________。
【答案】 平衡容器内气压,使漏斗中液体顺利流下 抽滤瓶 加快过滤速率 防止浓H2SO4将有机物氧化或炭化 使反应物充分接触反应,提高反应产率 89.3%
【解析】试题分析:(1)装置b中将活塞上下部分连通使漏斗内压强与三口烧瓶内压强相同。
(2)根据图示回答装置c的名称,抽滤瓶内压强小于大气压,水流速快。
(3)浓硫酸具有脱水性、强氧化性。
(4)反应需要搅拌12 h,使反应物充分接触反应,提高反应产率。
(5)实验产率=实际产量÷理论产量×100%。
解析:(1)装置b中将活塞上下部分连通,起到平衡容器内气压,使漏斗中液体顺利流下的作用。
(2)根据图示,装置c的名称是抽滤瓶,抽滤瓶内压强小于大气压,水流速快,加快过滤速率。
(3)浓硫酸具有脱水性、强氧化性,浓硫酸需要冷却至0℃以下防止浓H2SO4将有机物氧化或炭化。
(4)反应需要搅拌12 h,使反应物充分接触反应,提高反应产率。
(5)根据反应方程式,0.12mol乙酰乙酸乙酯理论上生成4,7—二甲基香豆素的物质的量0.21mol,实验产率=![]() 89.3%。
89.3%。

 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案【题目】实验室以蛇纹石酸浸出液(主要含Fe3+,还有一定量的Al3+、Mn2+、Ca2+、Mg2+等)为原料制备高纯氧化铁,流程如下:

已知流程中相关金属离子生成氢氧化物沉淀的pH如下表:
氢氧化物 | Fe3+ | Fe2+ | Al3+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 |
沉淀完全的pH | 3.2 | 8.8 | 5.0 |
(1)“还原”时,应选择_____________(填字母)。
A.Zn粉 B.NaClO溶液 C.Fe粉
(2)“滤渣”的主要成分除含有少量MnF2外,还含有_____________(填化学式)。
(3)“沉锰”时,已知:Ksp(MnS)=4.65×10–14。为确保沉锰完全[即溶液中c(Mn2+)<1.0×10–6 mol·L1],应保持溶液中c(S2-)>_____________mol·L-1。
(4)“除铝”时,控制溶液pH的范围为_____________。
(5)“氧化”时,常用酸性K2Cr2O7溶液检测是否残留未被氧化的金属离子,该反应的离子方程式为_____________。
(6)“沉铁”时,反应温度为85℃条件下,反应时间和反应终点pH对铁的沉淀率的影响分别如下图所示,则最佳的工艺条件是_____________。

【题目】下列用品的有效成分及用途对应错误的是
选项 | A | B | C | D |
用品 | 食盐 | 小苏打 | 复方氢氧化铝片 | 漂白粉 |
有效成分 | NaCl | Na2CO3 | Al(OH)3 | Ca(ClO)2 |
用途 | 做调味品 | 做发酵粉 | 做抗酸药 | 做消毒剂 |
A. A B. B C. C D. D
